Частинка в прямокутній потенціальній ямі
У випадку одномірної потенціальної ями потенціальна енергія частинки U(x) набуватиме такі значення (для простоти приймаємо, що частинка рухається вздовж осі ОХ) (рис. 176):

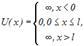 де
де  – ширина “ями”, а енергія відраховується від дна ями.
– ширина “ями”, а енергія відраховується від дна ями.
Рівняння Шредінгера у випадку одномірної ями запишемо у вигляді 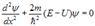 .
.
За умовою задачі (нескінченно високі "стінки") частинка не проникає за границі "ями", тому імовірність її виявлення за границями "ями" дорівнює нулю. На границях "ями" (при x = 0 і x = l) неперервна хвильова функція повинна перетворюватися в нуль. Отже, граничні умови мають вигляд  .
.
В границях "ями" ( ) рівняння Шредінгера має вигляд
) рівняння Шредінгера має вигляд
 ,
,  ,
,
де  .
.
Загальний розв’язок цього диференціального рівняння:
 .
.
Оскільки  , то
, то  . Отже,
. Отже,
 .
.
Умова  виконується лише при
виконується лише при  , де n – цілі числа, тобто необхідно, щоб
, де n – цілі числа, тобто необхідно, щоб  . Тоді
. Тоді
 i
i  .
.
Рівняння Шредінгера задовольняється лише при значеннях  , що залежать від цілого числа n.
, що залежать від цілого числа n.
Отже, енергія  частинки в потенціальній "ямі" з нескінченно високими стінками не може бути довільною, а набуває лише певних дискретних значень, тобто квантується. Квантові значення енергії
частинки в потенціальній "ямі" з нескінченно високими стінками не може бути довільною, а набуває лише певних дискретних значень, тобто квантується. Квантові значення енергії  називають рівнями енергії, а число n, яке визначає енергетичні рівні частинки, називають квантовим числом.
називають рівнями енергії, а число n, яке визначає енергетичні рівні частинки, називають квантовим числом.
Знайдемо власні хвильові функції
 .
.
Сталу інтегрування A визначаємо з умови нормування  . Звідси
. Звідси  . Тоді власна хвильова функція має вигляд:
. Тоді власна хвильова функція має вигляд:
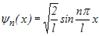
 ,.
,.
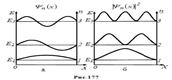
На рис. 177, а наведені графіки функції  при
при  , рис. 177, б – густини ймовірності знаходження частинки на різних відстанях від “стінок” ями для
, рис. 177, б – густини ймовірності знаходження частинки на різних відстанях від “стінок” ями для  .
.
Наприклад, у квантовому стані з n = 2 частинка не може знаходитись посередині "ями" і в той же час однаково часто може перебувати в її лівій або правій частині.
31. Проходження частинки крізь потенціальний бар”єр. «Тунельний ефект».
32. Атом водню. Головне, азимутне і магнітне квантові числа. Спін електрона. Спінове квантове число.
Спін (англ. spin — веретено) — фундаментальна характеристика частинки (наприклад атомного ядра чи елементарної частки), яка в деякому відношенні аналогічна «власному моменту імпульсу частинки». Спін є квантовою властивістю частинок і не має аналогів у класичній фізиці. Тоді як класичний момент імпульсу виникає внаслідок обертання масивного тіла зі скінченними розмірами, спін властивий навіть частинкам, які на сьогодні вважаються точковими, і не пов’язаний із жодним обертанням мас всередині такої частки. (Спін неточкових частинок, наприклад атомних ядер чи адронів, є векторною сумою спінів та орбітального моменту імпульсу її складових. Тобто і у цьому випадку спін лише частково пов’язаний з обертальним рухом всередині частинки.)Спін може набувати лише певні (квантовані) значення:
· цілі: 0,1,2,3 ...
· напівцілі: 1/2, 3/2, ...Спін є важливою характеристокю елементарних часток.
· Головне, орбітальне і квантове число .Для атома водню поняття „власний стан атома” і „стан електрона в атомі” еквівалентні, оскільки у ньому є тільки 1 електрон. Тому квантові числа в атомі водню однозначно характеризують як стан внутрішнього руху атома, так і стан електрона.
· 1. n – головне квантове число, набуває цілих позитивних значень (n=1,2,3,…, 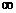 ). Вказує на повну енергію електронів атомів:
). Вказує на повну енергію електронів атомів:  . Вказує на номер енергетичного рівня. Також головне квантове число вказує на розміри електронної хмарки і кількість підрівнів на енергетичному рівні. У випадку коли n не ціле гамільтоніан немає рішення. Власні значення для атома водню для його дискретної частини визначається наступними співвідношеннями:
. Вказує на номер енергетичного рівня. Також головне квантове число вказує на розміри електронної хмарки і кількість підрівнів на енергетичному рівні. У випадку коли n не ціле гамільтоніан немає рішення. Власні значення для атома водню для його дискретної частини визначається наступними співвідношеннями:
· l – орбітальне квантове число. Вказує на форму електронної хмарки та механічний момент електрона навколо ядра. Із теорії Бора – електрон рухаючись по орбіті, повинен мати дискретний момент імпульса
· 
 Орбітальне квантове число може приймати значення: l=0,1,2,3,…,n-1
Орбітальне квантове число може приймати значення: l=0,1,2,3,…,n-1
·
· Квантове число l визначає розмір орбітального моменту, але не визначає напрямок орбітального моменту це є скаляр.
· 
 . Магнітне квантове число – ml, що описує орієнтацію електронної хмарки в навколо ядерного просторі.
. Магнітне квантове число – ml, що описує орієнтацію електронної хмарки в навколо ядерного просторі.
33. Розподіл електронів в атомі по енергетичним рівням. Принцип Паулі.
34. Аквнтові явища в твердих тілах. Утворенняенергетичних зон в кристалах
35. Склад і характеристика атомного ядра.