Окислительно-восстановительные потенциалы
Нормальный водородный электрод. Для сравнения окислительно-восстановительной способности различных атомов и ионов составляют гальваническую цепь из испытуемой пары (например, Zn+4VZn) и нормального водородного электрода (2Н+/Нг).
Нормальный водородный электрод состоят из платиновой пластинки (выполняющей роль инертного проводника электричества), на которую электролитически наносят слой платиновой черни. Платиновая чернь, представляющая собой платину в тонкодисперсном состоянии, обладает способностью адсорбировать газообразный водород. Пластинку опускают в раствор хлористоводородной или серной кислоты с активной концентрацией ионов водорода ан+, равной 1 (используется 1,25 M раствор хлористоводородной кислоты).
Во время работы очищенный газообразный водород непрерывно пропускают под давлением 1 атм через хлористоводородную или серную кислоту. При этом протекает обратимая реакция;
H2 ^=± 2H+ + 2е.
аналогичная реакциям, протекающим на поверхности металлических электродов.
Величина потенциала нормального водородного электрода условно приравнивается к нулю.
Нормальные окислительно-восстановительные потенциалы. Схема гальванической цепи хлорида железа в паре с нормальным водородным электродом может быть представлена следующим образом:
_2е_
1 ф
- (Pt1) H2 ! 2H+ И Fe++ I Fe+++ (Pt11) +
а химическую реакцию, происходящую в этой цепи, можно выразить уравнением:
I +
H2 + 2Fe+++ —> 2H+ + 2Fe4+
При концентрации (активности) ионов, равной 1, давлении водорода 1 атм и температуре +250C разность потенциалов на концах гальванической цепи (платиновых полюсах) равна +0,771 в.
Потенциалы, измеренные в паре с нормальным водородным электродом при концентрации (активности) ионов, равной 1, и температуре 25° С, называются нормальными (E0).
Знак плюс у электрода означает, что электроны движутся от нейтральных молекул водорода к Fe4+^-HOHaM1 т. е. водород окисляется, a Fe+++ восстанавливается. Пара Fe+4VFe4+ является положительным полюсом. Если сделать такие определения для разных пар, то получим данные, которые могут служить для сравнения окислительно-восстановительной способности различных соединений.
В гальванической цепи
2е
- (Pt1)H212H+ Il Sn++ I Sn++++(Pt„) +
разность потенциалов составляет +0,15 в. Это означает, что Sn4444* окисляет H2.
FeCl3 более сильный окислитель, чем SnCl4, и Fe+44* будет окислять Sn++ до SnIv. В гальванической цепи
2<?
- (Pt1)Sn++ I Sn++++ И Fe++ I Fe+++(Ptn) +
разность потенциалов равна 0,771 — (+ 0,15) = +0,621 в, что подтверждает возможность окисления Sn++ при помощи Fe+++-noHOB.
Если составить цепь из металлического магния, его соли и водородного электрода, то поток электронов будет двигаться от магния к ионам водорода:
_2£_
I I
- (Pti)Mg I Mg++ Il H212H+(Ptn) +
Это означает, что ионы водорода в данном случае являются окислителем. Измеренная разность потенциалов равна —2,34 в. Следовательно, металлический магний по отношению к паре 2Н+/Н2 является восстановителем. Число —2,34 в есть мера восстановительной способности магния.
Таблица нормальных окислительно-восстановительных потенциалов.
В табл. 5 приведены численные значения некоторых нормальных окислительно-восстановительных потенциалов. Если атомы, молекулы или ионы, находящиеся в правой колонке табл. 5, вступают в реакции с атомами, молекулами или ионами, находящимися в левой колонке и притом расположенными ниже, то первые теряют электроны (окисляются), т. е. являются восстановителями, а вторые принимают электроны (восстанавливаются), т. е. являются окислителями.
Для нахождения электродвижущей силы (э. д. с.) реакции нужно из величины потенциала окислителя вычесть величину потенциала восстановителя:
Э. Д. С. (E)— Е0КцСл — £восст
Нормальная (стандартная) э. д. с. равна разности нормальных потенциалов (при а = 1). Например:
I I
Zn + Cu++ —> Zn+++ Cu для Zn - 2е —V Zn++ E0 = - 0,7620 в (а)
для Cu++ + 2е —>- Cu £° = + 0,3448 в э. д. с. = 0,3448 - (-0,7620) = 1,1068 в 2е I I
Fe+ 2H+ —> Fe++ + H2 для Fe - 2е —> Fe++ £° = - 0,440 в (б)
для 2H+ + 2е —> H2 E0 = 0,000 в э. д. с. = 0,000-(-0,440) = 0,440 в
2е
I I
Sn++ + Hg++ —> SnIV + Hg для Sn++ -2е —> SnIV £0= +0,15 * (в)
для Hg++ + 2е —> Hg £° = + 0,854 в э. д. с. = 0,854 - 0,15 = 0,704 в
142. Поверхностная энергия, энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объеме. При увеличении поверхности раздела фаз удельная полная поверхностная энергия (на единицу поверхности) e характеризует увеличение энергии системы. Она равна сумме механической работы s образования единицы площади поверхности и поглощаемой при этом теплоты q. B обратимом изотермическом процессе  , где Т-абсолютная температура, —
, где Т-абсолютная температура, —  -удельная поверхностная энтропия (связанная энергия). Обычно, говоря о поверхностная энергия, имеют в виду удельную свободную поверхностная энергия s. С ростом температуры вдали от критической точки s линейно уменьшается, тогда как e практически от температуры не зависит. При приближении к критической точке различие в свойствах контактирующих фаз сглаживается и поверхностная энергия обращается в нуль (см. Критическое состояние). Термин "поверхностная энергия" применяют обычно для границы твердое тело-газ (пар); если граничащие фазы суть твердое тело и жидкость или две несмешивающиеся жидкости, пользуются термином "межфазная энергия". Удельная свободная поверхностная энергия на границе раздела жидкость-газ (пар) называется поверхностным натяжением.
-удельная поверхностная энтропия (связанная энергия). Обычно, говоря о поверхностная энергия, имеют в виду удельную свободную поверхностная энергия s. С ростом температуры вдали от критической точки s линейно уменьшается, тогда как e практически от температуры не зависит. При приближении к критической точке различие в свойствах контактирующих фаз сглаживается и поверхностная энергия обращается в нуль (см. Критическое состояние). Термин "поверхностная энергия" применяют обычно для границы твердое тело-газ (пар); если граничащие фазы суть твердое тело и жидкость или две несмешивающиеся жидкости, пользуются термином "межфазная энергия". Удельная свободная поверхностная энергия на границе раздела жидкость-газ (пар) называется поверхностным натяжением.
Поверхностная энергия связана с межмолекулярным взаимодействием, так как состояние частиц (атомов, молекул) на границе раздела фаз отличается от состояния в объеме фаз вследствие нескомпенсированности силовых полей частиц на поверхности раздела. Состояние поверхности и поверхностные силы играют существенную роль в тех случаях, когда поверхность сильно развита (например, в высокодисперсных системах), при получении вещества в виде тонких пленок. когда сфера действия приповерхностных сил соизмерима с толщиной пленок, в капиллярных явлениях. При образовании (увеличении) поверхности раздела фаз затрачивается работа против нескомпенсированных сил межчастичного взаимодействия на поверхности. Поверхностная энергия s определяется как работа образования единицы площади поверхности (размерность Дж/м2) или как сила, приложенная к контуру на поверхности и препятствующая увеличению поверхности; тогда ее размерность Н/м. Для жидкостей молекулярной природы и твердых тел поверхностная энергия s равна: сжиженные инертные газы-единицы мДж/м2, орг. вещества-десятки мДж/м2, вещества ионной природы - первые сотни мДж/м2, металлы-от долей Дж/м2 (легкоплавкие) до нескольких Дж/м2 (тугоплавкие).
Экспериментальное измерение поверхностной энергии в твердых телах представляет собой трудную задачу из-за медленного (по сравнению с жидкостью) протекания релаксационных процессов и большой диссипации энергии при разрушении и образовании новой поверхности, что обычно затрудняет проведение этого процесса как изотермического обратимого. Существует несколько методов измерения поверхностная энергия твердых тел, из которых наиболее достоверные результаты дает метод нулевой ползучести (Таммана-Удина), основанный на наличии у тела вязкой ползучести, то есть способности при достаточно высокой температуре медленно течь под действием приложенной силы. Графическая интерполяция величины этой силы к значению, при котором вязкая ползучесть уравновешивается поверхностным натяжением s, позволяет определить поверхностную энергию. Для упругих тел с хрупким разрушением поверхностную энергию можно определить лишь в случаях совершенной спайности, например при обратимом расщеплении листочка слюды. путем измерения работы образования поверхности (метод Обреимова); последний применим также для определения межфазной энергии на границе твердое тело-жидкость.
Пове́рхностное натяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Поверхностное натяжение имеет двойной физический смысл — энергетический (термодинамический) и силовой (механический). Энергетическое (термодинамическое) определение: поверхностное натяжение — это удельная работа увеличения поверхности при её растяжении при условии постоянства температуры. Силовое (механическое) определение: поверхностное натяжение — это сила, действующая на единицу длины линии, которая ограничивает поверхность жидкости[1].
205. При гидролизе солей железа (III) образуется золь гидрата окиси железа с положительно заряженными частицами:
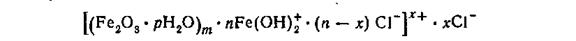
213.