Легкі конструкційні метали
Велике значення для машинобудування належить легким конструкційним металам, які мають достатньо питому міцність. Питома міцність – це відношення міцності матеріалу до щільності. З огляду на питому міцність і хімічну активність до легких конструкційних матеріалів відносять магній, берилій, алюміній, титан і сплави на їх основі.
Алюміній – сріблясто-білий метал, легкоплавкий (т.пл. 660,40С), легкий (густина 2,7 г/см3), механічно міцний, має добру електричну провідність і теплопровідність, легко утворює сплави і піддається обробці. Він має високу корозійну стійкість в окиснювальних середовищах внаслідок утворення непроникливої захисної плівки алюміній оксиду, завдяки цьому за звичайної температури алюміній практично не взаємодіє з концентрованою й сильно розведеною нітратною кислотою, дуже повільно розчиняється в нітратній кислоті середніх концентрацій, тому нітратну кислоту зберігають і перевозять в алюмінієвій тарі. Алюміній розчинний у хлоридній і сульфатній кислотах:
2Al + 6H+ = 2Al³+ + 3H2↑.
Зовсім не стійкий у лугах та лужних розчинах із рН = 9. Алюміній легко з’єднується з киснем на повітрі, покриваючись оксидною плівкою Al2O3, що захищає метал від подальшої корозії. Алюміній – метал, але нетиповий. З водою алюміній реагує, якщо плівка гідроксиду, що утвориться, буде розчинятися, що може бути досягнуте при додаванні до води лугу:
2Al + 2NaOH + 10H2O = 2Na[Al(OH)4(H2O)2] + 3H2↑.
У йонній формі: 2Al + 2OHˉ + 10H2O = 2[Al(OH)4(H2O)2]ˉ + 3H2↑.
Алюміній, у якого зруйнована оксидна плівка, хімічно активний:
2Al + 6H2O + 6H3O+ = 3H2↑ + 2[Al(H2O)6]3+.
За звичайних умов алюміній реагує з галогенами:
2Al + 3Cl2 = 2AlCl3.
При нагріванні алюміній взаємодіє з багатьма неметалами:
2Al + N2 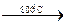 2AlN;
2AlN;
2Al + 3S 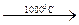 Al2S3;
Al2S3;
4Al + 3C 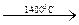 Al4C3.
Al4C3.
Алюміній є хорошим відновником багатьох оксидів металів, що використовується в металургії для одержання тугоплавких металів – ванадію, хрому, марганцю тощо. Наприклад:
2Al + Cr2O3 = Al2O3 + 2Cr.
Метод відновлення оксидів металів алюмінієм одержав назву алюмінотермії. На цьому методі ґрунтується один зі способів зварювання стальних виробів. Для цього суміш порошкоподібних алюміній оксиду й магнітного залізняку (Fe3O4 ), що має назву терміт, підпалюють за допомогою запалу. При цьому відбувається реакція:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe.
У результаті цієї екзотермічної реакції розвивається температура порядку 30000С. Залізо, що виділяється, у розплавленому вигляді тече на місце стику металевих деталей, зварюючи їх.
Алюміній оксид і алюміній гідроксид є амфотерними сполуками. Основні властивості цих сполук виявляються у реакціях з кислотами:
Al2O3+ 6HCl = 2AlCl3 + 3H2O;
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O.
Кислотні властивості алюміній оксид і алюміній гідроксид виявляють у реакціях з лугами в розчинах:
Al2O3 + 6KOH + 3H2O = 2K3[Al(OH)6];
Al(OH)3 + 3KOH = K3[Al(OH)6].
За поширеністю в земній корі алюміній посідає перше місце серед металів, його вміст у земній корі становить 8,8 %. Внаслідок високої хімічної активності алюміній зустрічається в природі тільки у вигляді сполук. Основним промисловим методом добування металічного алюмінію є електроліз розплаву, що містить алюміній оксид Al2O3 (глинозем) і кріоліт Na3AlF6. Електроліз відбувається при температурі 9500С. Добутий технічний алюміній (до 99,7 % Al) піддають очистці шляхом електрорафінування.
Магній відноситься до найбільш електропозитивних елементів. Від свого сусіда по періоду – алюмінію – магній відрізняється меншим числом валентних електронів і відносно більшим розміром атому, тому його здатність утворювати ковалентний зв’язок у порівнянні з алюмінієм знижена. Для магнію характерне утворення йонного зв’язку. Магній у вигляді простої речовини – білий метал, легко окиснюється повітрям, приймає матовий відтінок. Магній – активний метал, легко вступає у взаємодію з галогенами, при нагріванні згорає на повітрі, окиснюється сіркою та азотом. У електрохімічному ряді напруг магній розташований перед воднем. Він майже не взаємодіє з холодною водою, тому що магній гідроксид, який утворюється при цьому, погано розчинний у воді. При нагріванні реакція між магнієм і водою прискорюється за рахунок розчинення Mg(OH)2. У кислотах магній розчиняється дуже енергійно, за винятком HF i H3PO4, які утворюють із ним малорозчинні сполуки. Розбавлену нітратну кислоту (з масовою часткою кислоти 10-15 %) метал відновлює до амоній нітрату:
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O.
З лугами магній практично не взаємодіє. За хімічною природою сполуки Mg (II) – переважно основні. Більшість його солей розчинні у воді. Малорозчинні солі слабких кислот – Mg3(PO4)2 ; MgCO3, MgF2. Магній карбонат розчиняється у воді в присутності CO2, перетворюючись у розчинний магній гідрогенкарбонат:
MgCO3 + CO2 + H2O = Mg(НCO3)2.
Магній може відновлювати багато металів з їхніх оксидів і солей:
TiCl4 + 2Mg = Ti + 2MgCl2.
Магній оксид і магній гідроксид виявляють основні властивості.
При змішуванні магній хлориду з водою й магній оксидом утворюється магній гідроксидхлорид:
MgCl2 + MgO + H2O = 2MgOHCl,
який при змішуванні з водою утворює масу, яка швидко твердіє, що дозволяє використовувати його як цемент. Магній входить до складу мінералів магнезиту, доломіту, карналіту (додаток 1).
Титан–сріблясто-білий метал. При звичайних температурах хімічна активність титану надзвичайно мала. Це пояснюється тим, що на свіжій поверхні чистого титану дуже швидко з’являється інертна плівка діоксиду титану, яка добре „зростається” з металом і захищає його від подальшого окиснення.
Титан із галогенами може утворювати тетрагаліди:
Ti + 2Cl2 = TiCl4.
Флуор і хлор реагують з титаном на холоду, а бром і йод – при температурі вище 2500С. Титан при високій температурі утворює також сполуки з азотом – нітрид (TiN), який використовується для полірування коштовного каміння; з вуглецем – карбід (TiC), що використовується для виготовлення абразивних інструментів.
Титан не може протистояти дії гідроген пероксиду, сухим хлору й брому, спиртам та ортофосфатної кислоти, навіть слабкої концентрації.
Титан стійкий у багатьох агресивних середовищах, особливо в слабких розчинах нітратної кислоти, де він пасивується, хлорорганічних сполуках. Однак титан розчиняється у кислотах, які здатні руйнувати захисну плівку, наприклад, розведені хлоридна, сульфатна та флуоридна кислоти:
2Ti + 6HCl 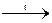 2TiCl3 + 3H2.
2TiCl3 + 3H2.
2Ti + 3H2SO4 = Ti2(SO4)3 + 3H2.
2Ті + 6НF = 2TiF3 + 3H2.
Сполуки, де титан виявляє ступінь окиснення +3, мають червоно-фіолетове забарвлення різних відтінків: Ті(ОН)3 – вишнево-червоний, TiF3 – пурпурово-червоний, TiCl3 – фіолетовий, TiBr3 – червоно-фіолетовий.
На повітрі при звичайній температурі титан досить стійкий. При високій температурі (1200-13000C) він бурхливо реагує з киснем повітря, утворюючи оксид TiO2, причому реакція супроводжується яскравим світінням. Титан (ІV) оксид TiO2 – хімічно малоактивна речовина. Цей оксид є амфотерною сполукою, проте він реагує з кислотами тільки при нагріванні, а з лугами – при сплавлянні з утворенням титанатів:
TiO2 + H2SO4 = TiO(SO4) + H2O;
TiO2 + 2KOH = K2TiO3+ H2O.
Сульфатна кислота, так само як і хлоридна, руйнує захисну плівку діоксиду титану й підвищує розчинність металу. Її можна різко знизити, якщо до розчинів цих кислот додати певну кількість нітратної, хромової кислот, сполук хлору чи інших окисників, що швидко пасивують поверхню титану захисною плівкою, і припиняють його подальше розчинення.
Титан – хімічно активний, і в той же час титан є одним із деяких металів, що мають винятково високу корозійну стійкість. Титан практично вічний в атмосфері повітря, у холодній і киплячій воді, дуже стійкий у розчинах багатьох солей, неорганічних і органічних кислотах. За своєю корозійною стійкістю в морській воді він перевершує всі метали, за винятком благородних металів – золота, платини, більшість видів нержавіючої сталі, нікелеві, мідні й інші сплави. Протистоїть титан і ерозійній корозії, що відбувається в результаті сполучення хімічного й механічного впливу на метал. У цьому відношенні він не поступається кращим маркам нержавіючих сталей, сплавам на основі міді й інших конструкційних матеріалів.
У хімічній промисловості використовують, в основному, технічно чистий титан, який має найбільшу корозійну стійкість. Для особливо агресивних середовищ застосовують сплави титану з молібденом, паладієм, нікелем та цирконієм, що підвищують його стійкість у десятки й сотні разів. Найбільший ефект досягається завдяки добавкам у титан чотирьох металів платинової групи: платини, паладію, родію й рутенію.