Метали родин феруму й купруму
Залізо за поширеністю в природі займає друге місце серед металів (після алюмінію). На нього припадає 4,85 % маси земної кори. Найважливішими природними сполуками заліза, що мають промислове значення, є магнітний залізняк Fe3O4, червоний залізняк Fe2O3, бурий залізняк Fe2O3·nH2O та пірит FeS2. Оксиди феруму є рудами, з яких добувають залізо, а пірит – сировиною для сульфатно-кислотного виробництва. Залізо – блискучий сріблясто-білий важкий метал, який має густину 7,86 г/см3 і температуру плавлення 15380C. Залізо досить пластичне, легко кується, штампується, витягується в дріт і прокатується в тонкі листи, легко намагнічується й розмагнічується. Атоми Феруму можуть легко втрачати два, або три електрони й перетворюватись в катіони Fe2+ і Fe3+. Сполуки тривалентного феруму стійкіші. При нагріванні залізо може легко реагувати із хлором, сіркою та іншими неметалами:
2Fe + 3Cl2 = 2FeCl3; Fe + S = FeS.
Залізо реагує з водою при нагріванні (до 5000С):
3Fe + 4H2O = Fe3O4 + 4H2↑.
В електрохімічному ряді напруг залізо стоїть лівіше від водню, тому воно легко реагує з розведеними хлоридною, сульфатною, нітратною кислотами:
Fe + 2HCl = FeCl2 + Н2↑; Fe + H2SO4 = FeSO4 + H2↑.
Продукти взаємодії залежно від концентрації нітратної кислоти можуть бути різними:
4Fe + 10HNO3 = 4Fe(NO3)2 + NН4NO3 + 3H2O;
Fe + 6HNO3 = Fe(NO3)3 + 3NO2↑ + 6H2O.
Залізо без нагрівання не реагує з концентрованими нітратною та сульфатною кислотами. Воно стає «пасивним», укриваючись тонкою оксидною плівкою, яка не розчиняється в кислотах, і ізолює метал від дії кислоти. Завдяки цьому концентровані нітратну й сульфатну кислоти можна зберігати й транспортувати в залізній тарі. При нагріванні залізо окиснюється цими концентрованими кислотами:
Fe + 4HNO3 = Fe(NO3)3 + NO↑ + 2H2O;
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 2H2O.
Оскільки оксиди феруму з водою не реагують, то його гідроксиди одержують дією лугів на розчини солей феруму. Наприклад:
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4;
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl.
Ферум (ІІ) гідроксид Fe(OH)2 утворюється у вигляді драглистого осаду блідо-зеленого кольору. При доступі кисню повітря легко окиснюється й перетворюється в бурий драглистий осад ферум (ІІІ) гідроксиду. Обидва гідроксиди у воді й розчинах їдких лугів не розчиняються, а в кислотах розчиняються легко. Наприклад:
Fe(OH)2 + 2HCl = FeCl2 + 2H2O;
Fe(OH)3 + 3HCl = FeCl3 + 3H2O.
Розчини солей феруму (ІІ) безбарвні, а розчини солей феруму (ІІІ) мають жовте забарвлення. Солі феруму (ІІ) під дією окисників виявляють відновні властивості:
10FeSО4 + 2КМnО4 + 8Н2SО4 = 5Fe2(SО4)3 + 2МnSО4 + K2SO4 + 8Н2О.
Йони Fe2+ утворюють з розчином калій гексаціанофератом (ІІІ) (червоної кров’яної солі) синій осад турнбулевої сині або ферум (ІІ) гексаціаноферату (ІІІ):
3FeCl2 + 2К3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 6KCl.
Солі феруму (ІІІ) – слабкі окисники:
2FeCl3 + 2КI = 2FeCl2 + I2 + 2KCl.
Для якісного виявлення йонів Fe3+ використовують наступні рекції.
Йони Fe3+ утворюють з розчинами роданіду калію або амонію забарвлений у яскраво-червоний колір ферум (ІІІ) роданід:
Fe3+ + 3CNS– = Fe(CNS)3.
Йони Fe3+ утворюють з розчином калій гексаціанофератом (ІІ) К4[Fe(CN)6] (жовтої кров’яної солі) синій осад берлінської лазурі:
4Fe3+ + 3[Fe(CN)6]4– = Fe4[Fe(CN)6]3.
У сухому повітрі при звичайній температурі залізо досить стійке, але у вологому – швидко ржавіє, укриваючись товстим шаром іржі. Іржа являє собою суміш оксидів і гідроксидів феруму. Процес корозії заліза можна зобразити такими рівняннями:
2Fe + O2 + 2Н2О = 2Fe(OH)2; 4Fe(OH)2 + O2 + 2Н2О = 4Fe(OH)3;
Fe(OH)2 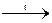 FeO + H2O; 2Fe(OH)3
FeO + H2O; 2Fe(OH)3 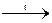 Fe2O3 + 3H2O.
Fe2O3 + 3H2O.
Іржа досить крихка й пориста. Тому вона не може ізолювати метал від атмосфери, через що процес корозії відбувається безперервно.
При високій температурі залізо легко сполучається з киснем, утворюючи окалину Fe3O4 (FeO · Fe2O3).
Залізо та його сполуки мають велике значення в промисловості. Сплави заліза з вуглецем та іншими речовинами є основними конструкційними матеріалами. Пірит FeS2 використовується у виробництві сірки та сульфатної кислоти. Оксид Fe2O3 застосовують у виробництві фарб, кераміки, емалей, цементу, термітних сумішей, магнітних матеріалів.
У родину феруму входять такі метали як кобальт і нікель, хімічна активність яких менша ніж у заліза. Кобальт і нікель добувають із поліметалічних руд, які піддають ряду послідовних операцій збагачення металом. До них відносяться перетворення сполук кобальту в оксиди з послідовним відновленням алюмінотермією або електролізом розчинів. Нікол (ІІ) сульфід піддають окиснювальній плавці, і одержаний оксид відновлюють вуглецем. Очистка нікелю від інших супутніх металів здійснюється електролітичним шляхом. Кобальт і нікель застосовують як легуючі метали в сталях, щоб надати їй специфічні властивості (сталі нержавіючі, інструментальні, з особливими магнітними властивостями). Значна кількість кобальту використовується у виробництві надтвердих матеріалів на основі карбідів титану та вольфраму, а нікель використовується для нікелювання, тобто для обробки поверхонь виробів з інших металів.
Мідь – м’який, пластичний метал, що має рожево-червоне забарвлення, високу електричну провідність, температуру плавлення 10830С. Мідь – хімічно малоактивний метал.
Мідь не реагує з водою, розчинами лугів, хлоридною й розбавленою сульфатною кислотами. При нагріванні реагує із сіркою й хлором, утворюючи Cu2S та CuCl2.
Мідь розчиняється в кислотах, які є сильними окисниками:
3Cu + 8HNO3 (розб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O;
Cu + 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O.
Купрум утворює такі оксиди: Cu2O (червоно-коричневий) має основний характер, CuO і Cu2O3 чорного кольору, CuO – амфотерний (із перевагою основних властивостей), Cu2O3 – слабко кислотний характер. Оксиди реагують із кислотами з утворенням солей:
Cu2O + 2HCl = 2CuCl + H2O;
CuO + H2SO4 = CuSO4 + H2O.
При нагріванні вище 11000С купрум (ІІ) оксид розкладається на купрум (І) оксид та кисень. У вологій атмосфері мідь поступово вкривається зеленуватим шаром купрум (ІІ) гідроксидкарбонату:
Cu + O2 + CO2 + H2O = (CuOH)2CO3 (малахіт).
При дії лугів на розчини солей Cu (II) утворюється купрум (ІІ) гідроксид блакитного кольору:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4.
Купрум (ІІ) гідроксид – слабка основа, яка невеликою мірою виявляє амфотерні властивості – вона при нагріванні розчиняється в концентрованих розчинах лугів з утворенням тетрагідроксокупрат (ІІ) йонів:
Cu(OH)2 + 2KOH = K2[Cu(OH)4],
а також у розчинах кислот:
Cu(OH)2 + 2HCl + 2H2O = [Cu(H2O)4]Cl2.
При нагріванні Cu(OH)2 легко розкладається:
Cu(OH)2 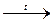 CuO + H2O.
CuO + H2O.
Із солей купруму (ІІ) найбільше практичне значення має CuSO4∙5H2O – мідний купорос (блакитного кольору). При нагріванні мідний купорос втрачає воду. Безводний CuSO4 безбарвний.
При взаємодії розчину купрум (ІІ) сульфату з аміачною водою утворюється блакитний осад купрум (ІІ) гідроксидсульфату:
2CuSO4 + 2NH3∙H2O = (CuOH)2SO4↓ + (NH4)2SO4.
Під дією надлишку амоніаку утворюється катіон тетраамінокупруму (ІІ) інтенсивного синього кольору:
(CuOH)2SO4 + 8NH3∙H2O = [Cu(NH3)4]SO4 + [Cu(NH3)4](OH)2 + 8H2O.
Солі купруму (ІІ) мають окиснювальні властивості. Так, при додаванні до розчину CuSO4 калій йодиду виділяється йод та білий осад купрум (І) йодиду:
2CuSO4 + 4KI = 2CuI↓ + I2 + 2K2SO4.
Вихідною сировиною для добування міді найчастіше є сульфідні руди. Для добування міді купрум (І) сульфід Cu2S спочатку піддають окиснювальному випалюванню:
Cu2S + 2O2 = 2CuO + SO2.
До купрум (ІІ) оксиду, що утворився, додають нову порцію сульфіду й при високій температурі відбувається реакція:
2CuO + Cu2S = 4Сu + SO2.
Одержують технічний метал, що містить 97-98 % Купруму. Для добування чистішої міді, яку використовують в електротехніці, проводять електрорафінування металу у водному розчині купрум (ІІ) сульфату. Чиста електролітична мідь містить 99,98-99,99 % Сu.
Основна маса міді (електролітичної), що виробляється, використовується в електротехнічній промисловості та при одержанні сплавів: бронзи, алюмінієвої та берилієвої бронзи, мельхіору, константану, латуні.