рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Определения продуктов реакции и нахождения стехиометрических коэффициентов
Реферат Курсовая Конспект
Определения продуктов реакции и нахождения стехиометрических коэффициентов
Определения продуктов реакции и нахождения стехиометрических коэффициентов - раздел Образование, ОВР включают два процесса две полуреакции: окисление и восстановление 1) Определяют Окислитель И Восстановитель. При Этом Удобно По...
1) Определяют окислитель и восстановитель. При этом удобно пользоваться списком типичных окислителей и восстановителей.
Важнейшие окислители:
электрический ток на аноде,
сильные — F2, О2, О3, Н2О2, С12 особенно в водном растворе), НСlO, НСlO3, H2SO4 (только концентрированная), HNO3 (любой концентрации), царская водка (смесь концентрированных HNO3 и НС1), HNO2, NO2, КМпО4 (особенно в кислом растворе), МпО2, К2Сг207, СгО3, РЬО2 и др.;
слабые — J2, бромная вода (Br2+H2O), SO2, HNO2, Fe3+ и др.
Важнейшие восстановители:
сильные — щелочные и щелочноземельные металлы, Mg, Al, HI и иодиды, НВг и бромиды, H2S и сульфиды, H2 (особенно в момент выделения), NH3, РН3, Н3РО3, С, СО, Fe2+, Cr2+ и др.;
слабые — малоактивные металлы (РЬ, Си, Ag, Hg), HC1 и хлориды, SO2, HNO2 и др.
2) Определяют, какие степени окисления приобретают окислитель и восстановитель после реакции. Чем более сильный окислитель участвует в реакции, тем выше поднимается степень окисления восстановителя.
Например, H2S под действием слабых окислителей превращается в S (S -2 → S°), a
под действием сильных окислителей — в H2SO4 (S -2 → S+6).
Аналогично, чем более сильный восстановитель реагирует с окислителем, тем сильнее понижается степень окисления окислителя.
Например, H2SO4 под действием слабых восстановителей превращается в SO2 (S+6 → S+4), а под действием сильных восстановителей — в H2S (S+6 → S -2).
3) Определяют, в виде каких соединений существуют окисленные и восстановленные элементы в данной среде (кислой, щелочной или нейтральной).
Окислители:
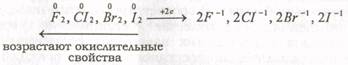 |
1. Некоторые типичные неметаллы:
а)
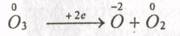 |
б)
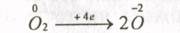 |
в)
2. некоторые оксиды металлов, содержащие атомы металлов в высшей степени окисления:
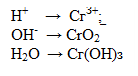 а)
а)
 СгОз
СгОз
+1 0
б) Ag2O + 2e →2 Ag
+4
в) РЬО2 +2е → РЬ2+ (характер продуктов также зависит от среды)
3. кислородсодержащие кислоты:
 концентрация кислоты
концентрация кислоты
а) азотная кислота: HNO3 → NO2, NO, N2O, N2, NH4+ (NH3)
активность восстановителя
неМе, малоактивные Me
NO2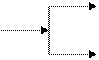
HNO3 (конц)
N2O
активные Me
неМе, малоактивные Me
NO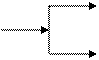
HNO3 (разб)
N2O; N2; NH4+ (NH3)
активные Me
Соли азотной кислоты являются слабыми окислителями.
+6 +4 0 -2
б) концентрированная серная кислота: Н2SО4(конц) → SO2, S, H2S
 |
активность восстановителя
Соли серной кислоты - слабые окислители.
в) кислородсодержащие кислоты галогенов и их соли:
НСlО, НСlО2, НС1О3, НСlO4 и их соли → Сl- (реже Сl2)
 |
Окислительные свойства возрастают
г) марганцевая кислота: НМnО4 → Мn2+
д) дихромовая кислота: H2 Сr2О7 → 2Сг3+
5) некоторые соли, содержащие атомы металлов в высшей степени окисления:

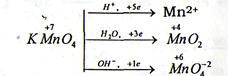
(продукты восстановления зависят от характера среды)
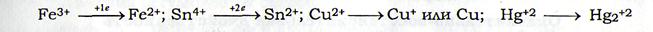 6) ионы металлов, находящиеся в высшей степени окисления:
6) ионы металлов, находящиеся в высшей степени окисления:
7) водород в степени окисления +1 выступает как окислитель преимущественно в растворах кислот:
2Н+ + 2е → Н2
Восстановителями называются вещества, атомы или ионы которых отдают электроны, при этом их степень окисления повышается.
К восстановителям относятся:
1) электрический ток на катоде;
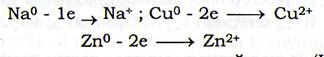 2) металлы (чем металл активнее, тем он более сильный восстановитель):
2) металлы (чем металл активнее, тем он более сильный восстановитель):
(Zn - характер продуктов зависит от среды:
в кислой среде (Н+) - Zn2+;
в щелочной (ОН-) - ZnО22-;
в нейтральной (Н2О) - Zn(ОН)2,
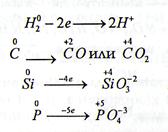 также у А1 и Сг)
также у А1 и Сг)
3) некоторые неметаллы:
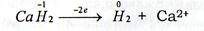
4) гидриды щелочных и щелочно-земельных металлов:
5) бескислородные кислоты: НСl, НВr, НJ → Сl2 , Вг2 , J2
 усиление восстановительной способности
усиление восстановительной способности
Соли этих кислот - слабые восстановители (кроме КJ)
-2 0 +4 +6
Н2S и ее соли → S,SО2,SО42-
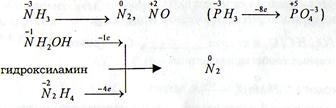
б) аммиак и его производные:
гидроксиламин
гидразин
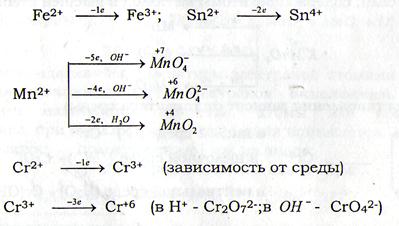 7) ионы металлов в низкой степени окисления:
7) ионы металлов в низкой степени окисления:
3) органические соединения до СО2 (кроме специфических реакций)
– Конец работы –
Эта тема принадлежит разделу:
ОВР включают два процесса две полуреакции: окисление и восстановление
Химические реакции протекающие с изменением степени окисления элементов... ОВР включают два процесса две полуреакции окисление и восстановление...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Определения продуктов реакции и нахождения стехиометрических коэффициентов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов