Теплоемкость газов
При термодинамическом равновесии состояние газа в целом может характеризоваться тремя параметрами: давлением P, объемом V и температурой Т.
Соотношение, связывающее между собой эти величины, называется уравнением состояния газа. Для идеального газа таковым является уравнение Клапейрона - Менделеева, которое для данной массы газа m имеет вид:
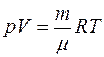 ,
,
где m - молярная масса газа,
R- универсальная газовая постоянная.
При равновесном переходе газа из одного состояния в другое, т.е. при термодинамическом процессе, должно выполниться первое начало термодинамики, которое можно сформулировать следующим образом:
количество теплоты dQ, переданное газу, идет на изменение его внутренней энергии dU и на работу dA, совершаемую газом против внешних сил: dQ = dU + dA
Элементарная работа dA=pdV, а внутренняя энергия одного киломоля идеального газа определяется по формуле
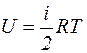 , (1)
, (1)
где i - число степеней свободы молекулы газа,
Для одноатомных молекул i=3 (только 3 поступательных степени свободы); для двухатомных i=5 (3 поступательных и 2 вращательных); для трех и более атомных i=6 (3 поступательных и 3 вращательных).
Теплоёмкостью С называется величина, равная отношению сообщенного телу при нагревании количества теплоты dQ к вызванному этим процессом изменению температуры dT:
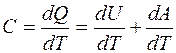
Различают удельную теплоемкость Cуд – теплоёмкость одного килограмма газа в молярную Сm - теплоёмкость одного киломоля газа. Эти теплоёмкости связаны между собой равенством:
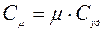
Теплоемкости для одного и того же газа не являются постоянными величинами, а зависят от характера процесса, при котором происходит нагревание газа, т.к. одному и тому же изменению температуры dT могут соответствовать различные значения работы dA.
Рассмотрим основные изопроцессы, протекающие в одном киломоле идеального газа и найдем соответствующие им теплоёмкости.
а) Изохорический процесс (V= const)
В этом случае dV=0, следовательно dA=0, и всё подводимое к газу количество теплоты идет на увеличение его внутренней энергии dU:
dQ = dU.
Тогда молярная теплоемкость при постоянном объёме, учитывая (I), равна:
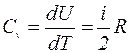 . (2)
. (2)
б) Изобарический процесс (p = const)
В этом случае молярная теплоемкость
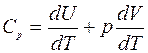 . (3)
. (3)
Из уравнения состояния газа для одного киломоля имеем:
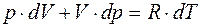 . (4)
. (4)
Т.к, p = const,то dp =0 и pdV=RdT. (4а)
Подставляя (4а) в (3) и заменяя dU согласно (2) на  , получим окончательно:
, получим окончательно:
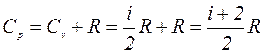 . (5)
. (5)
в) Изотермический процесс (T = const)
В этом случае dT =0 и dQ = dA,т.е. все подводимое количество теплоты идет на совершение газом работы, а его внутренняя энергия остается постоянной. Т.к. температура при этом не изменяется, то молярная теплоёмкость равна 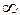 .
.
Элементарная работа при изотермическом процессе определяется уравнением
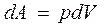
Полная работа
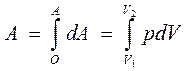
где V1 и V2 - начальный и конечный объем газа при изотермическом расширении
Из уравнения Клапейрона- Менделеева для любой массы газа
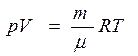
Находим давление 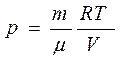
Тогда 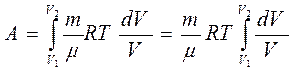
Данный интеграл имеет следующее решение
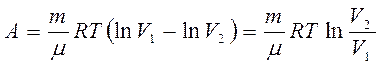
Итак, работа газа при изотермическом расширении определяется уравнением

г) Адиабатический процесс (dQ =0, dU + dA =0) – процесс, происходящий при отсутствии теплообмена между газом и окружающей средой. Т.к. при этом dQ =0,то молярная теплоёмкость равна нулю.
Выведем уравнение адиабатического процесса (уравнение Пуассона).
dA = -dU или pdV = -CvdT. (6)
Разделив равенство (4) на (6), учитывая (5),получим:
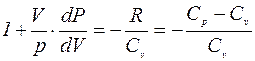 или
или  , (7)
, (7)
где 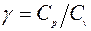 - отношение теплоемкостей, называемое показателем адиабаты.
- отношение теплоемкостей, называемое показателем адиабаты.
Если вместо Ср и Сv подставить в выражение для g их значения через число степеней свободы идеального газа i, то получим:
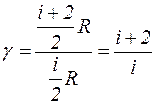 . (8)
. (8)
Интегрируя и потенцируя уравнение (7), получим уравнение Пуассона:
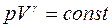 . (9)
. (9)
В данной работе определяется отношение g для воздуха по скорости звука в нем.