ОПЫТ 1. Восстановительные свойства металлов
Объяснение опыта
Элементы, отдающие электроны, т. е. имеющие небольшую энергию ионизации, называют металлами. Чем легче атом отдает электрон, тем сильнее его металлические свойства.
В химических реакциях потерю металлом электронов называют его восстановительной способностью. При этом металл окисляется. Большинство металлов – термодинамически неустойчивые системы, т.е. окисление металлов – процесс самопроизвольный, необратимый.

Каждый металл обладает определенной восстановительной способностью. Мерой окисляемости металла, его восстановительной способности является его потенциал. Чем меньше алгебраическая величина потенциала металла, тем больше его восстановительная способность.
Реакция  ,
,
возможна, если потенциал окислителя Eок больше потенциала восстановителя Евос(Ме)
 Еок – Евос(Ме) > 0.
Еок – Евос(Ме) > 0.
Образующиеся катионы можно обнаружить с помощью качественной реакции. При окислении железа образуется катион Fe2+, который с раствором красной кровяной соли, гексацианоферратом калия K3[Fe(CN)6] образует синий осадок - Fe3[Fe(CN)6]2 (турнбулева синь).

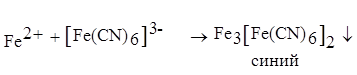
Проведение опыта
Реактивы: 0.5 Н раствор сульфата меди CuSO4;
0.5 Н раствор сульфата цинка ZnSO4;
0.5 Н раствор гексацианоферрата (II) калия K3[Fe(CN)6];
железная полоска (проволока) – 2 шт.
В одну пробирку налейте 10 капель 0.5 Н раствора сульфата меди CuSO4, а в другую - 10 капель 0.5 Н раствора сульфата цинка ZnSO4. В пробирки опустите хорошо зачищенные железные стержни.
Через несколько минут в первой пробирке на железном стержне появится красный налет. Напишите уравнение реакции и процессы окисления - восстановления. Укажите окислитель и восстановитель.
Через 10-15 минут после полного исчезновения голубого цвета раствора выньте из пробирки железный стержень и добавьте 2 капли раствора красной кровяной соли, гексацианоферрата (III) калия K3[Fe(CN)6]. Появление синего окрашивания указывает на присутствие в растворе катионов Fe2+. Напишите уравнение происходящего химического процесса.
Наблюдайте также через 10-15 минут, что происходит во второй пробирке. Чтобы убедиться, что в растворе нет катионов Fe2+, добавьте 2 капли раствора красной кровяной соли K3[Fe(CN)6]. Сделайте вывод, почему железо не вытесняет катионы  Zn2+ из раствора, а ионы Cu2+ вытесняет.
Zn2+ из раствора, а ионы Cu2+ вытесняет.
ОПЫТ 2. Окислительные свойства катиона Fe3+
Объяснение опыта
Если большинство металлов легко теряет электроны, то их катионы могут восстанавливаться только при действии сильного восстановителя. Потенциал катиона металла Fe3+, являющегося при этом окислителем, (Еок) должен быть больше потенциала восстановителят (Евос(Ме))
Еок – Евос(Ме) > 0.
Реакция FeCl3 + KI ® I2 + FeCl2 + KCl возможна, так как
Е0ок (Fe3+/Fe2+) = +0.77 B; Е0вос (I20/2I-) = +0.52 B
DE= Е0ок – Е0вос = 0.77 - 0.52 = 0.25 > 0.
Проведение опыта
Реактивы: 0.5 Н раствор хлорного железа, FeCl3;
0.5 Н раствор йодистого калия, KI.
Внесите в пробирку 3-4 капли 0,5 Н раствора йодистого калия KI и 5-6 капель 0.5 Н раствора хлорного железа (III). Отметьте изменение окраски раствора. Напишите уравнение реакции, процессы окисления и восстановления. Объясните возможность протекания реакции.