Раствора
Находят содержание CuSO4 в 1 л (1000 мл) раствора.
а) 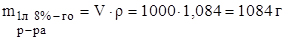
б) Раствор 8% - ный, поэтому
в 100 г раствора содержится 8 г CuSO4,
а в 1084 г раствора содержится х г CuSO4
( в 1 л)
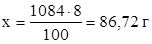
Расчет СМ(CuSO4):
Молярная масса CuSO4 - М(CuSO4)=160 г/моль.
Следовательно, число молей отвечающее 86,72 г CuSO4 :
 = 0,54 моль.
= 0,54 моль.
То есть СМ(CuSO4) = 0,54 моль/л.
Расчет СН(CuSO4):
Молярная масса эквивалента CuSO4 (эквивалентная масса CuSO4)
Мз(CuSO4) = 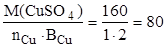 г/моль,
г/моль,
где n - число атомов меди,
В - валентность меди.
Следовательно, число молярных масс эквивалента
соответствующее 86,72 г CuSO4 равно:
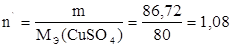 моль-экв.
моль-экв.
То есть, СН(CuSO4) = 1,08  .
.
Расчет Т(СuSO4):
 0,08572 г/мл.
0,08572 г/мл.
Проведение опыта
Реактивы: 10%-й раствор сульфата меди CuSO4;
10%-й раствор сульфата натрия Na2SO4;
10%-й раствор сульфата магния MgSO4;
10%-й раствор хлорида натрия NaCl;
дистиллированная вода.
Получив у преподавателя задание, выполняют расчеты, затем наливают исходный раствор и воду в бюретки. Уровни жидкости в бюретках устанавливают на нулевые отметки (по нижнему мениску) и выливают рассчитанные объемы раствора соли и воды в коническую колбу. Раствор перемешивают и переливают в цилиндр. Ареометром измеряют плотность приготовленного раствора (rпракт). Сравнивают с плотностью раствора заданной концентрации. Рассчитывают ошибку:
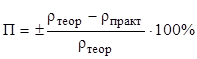
ЛАБОРАТОРНАЯ РАБОТА № 3