рефераты конспекты курсовые дипломные лекции шпоры
Реферат Курсовая Конспект
Спин электрона. Принцип Паули. Фермионы и бозоны.
Спин электрона. Принцип Паули. Фермионы и бозоны. - Лекция, раздел История, ЛЕКЦИЯ N 1 • Краткие исторические сведения. Тепловое излучение. Излучение абсолютно черного тела. Закон Кирхгофа. Итоги лекции N 1 Как Уже Упоминалось В Конце § 3 Предыдущей Лекции, Спектральные Линии Атома В...
Как уже упоминалось в конце § 3 предыдущей лекции, спектральные линии атома водорода обнаруживают тонкую структуру. Тонкая структура присуща спектрам всех атомов. Для объяснения причин возникновения тонкой структуры американские физики Гаудсмит и Уленбек выдвинули в 1925 г. гипотезу о том, что электрон обладает собственным моментом импульса - спином Ls, не связанным с движением электрона в пространстве. Модуль собственного момента импульса определяется спиновым квантовым числом s:

Для электрона s = 1/2.
Проекция спина на ось z, Lsz, квантуется

здесь ms - магнитное спиновое квантовое число. Для электрона

Квантовое состояние электрона в любом атоме задается четырьмя квантовыми числами:
главным n (n = 1, 2, 3...);
азимутальным l (l = 0, 1, 2, ...n-1);
магнитным ml (ml= -l,... -1, 0, 1 ... +l); (9.4)
спиновым ms (ms = +1/2, -1/2).
О физическом смысле первых трех квантовых чисел сказано в § 2 предыдущей лекции, о последнем - только что.
Энергия состояния зависит главным образом от квантовых чисел n и l. Есть слабая зависимость энергии от ml и ms, т.к. эти квантовые числа определяют взаимодействие между орбитальным и спиновым магнитными моментами электрона. Это взаимодействие приводит к появлению тонкой структуры спектров.
Принцип Паули утверждает, что в квантовой системе две тождественные частицы с полуцелым спином не могут находиться в одном и том же квантовом состоянии, т.е.
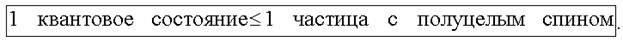
Этот принцип был сформулирован в 1925 г. швейцарским физиком В. Паули для электронов в атоме, а затем распространен на любые частицы с полуцелым спином - фермионы. К фермионам относятся электрон, протон, нейтрон.
Частицы с целым спином носят название бозонов. К бозонам относятся фотон (спин s = 1), мезон, составные частицы из четного числа фермионов, например,α -частица - ядро атома 42He. Бозоны могут находиться в одинаковом квантовом состоянии в неограниченном количестве.
§ 2. Физические основы периодической системы элементов Д. И. Менделеева
Принцип Паули, примененный к атому, утверждает, что в любом атоме не может быть двух электронов с одинаковым набором квантовых чисел n, l, ml, ms (9.5). Исходя из этого принципа, можно понять построение периодической системы элементов Д. И. Менделеева. Химические свойства атомов определяются внешними (валентными) электронами. Заполнение электронами квантовых состояний в атоме при учете принципа Паули приводит к периодически изменяющемуся с ростом зарядового числа Z характеру заполнения квантовых состояний валентными электронами. Этим и объясняется периодическое повторение химических свойств элементов. Поясним сказанное на примере первых одинадцати элементов периодической системы элементов Менделеева.
У водорода (H) один электрон, зарядовое число Z = 1, т.е. заряд ядра равен элементарному заряду +e. Состояния атома водорода без учета спина были нами разобраны в лекции N 8. В основном состоянии атома водорода квантовое число n = 1, l = 0, ml = 0. Квантовое число ms может быть как +1/2, так и -1/2. Говорят, что электронная конфигурация основного состояния атома водорода 1s. Энергия связи 1s электрона равна 13,6 эВ.
У атома гелия (He) зарядовое число Z = 2 и два электрона. Наборы квантовых чисел электронов отличаются квантовым числом ms; у одного из электронов ms=+1/2, у другого ms=-1/2 (при n = 1, l = ml = 0). Электронная конфигурация гелия 1s2. Это означает, что в 1s состоянии находятся два электрона с противоположными спинами. Электроны, имеющие одинаковое главное квантовое число n, образуют оболочку. В гелии оболочка с n = 1 заполняется полностью, поэтому гелий химически инертен. Энергия ионизации гелия равна 24,6 эВ.
Литий (Li) имеет зарядовое число Z = 3 и, соответственно, три электрона. Электронная конфигурация лития 1s22s, это значит, что третий электрон находится на второй оболочке, т.к. опуститься на первую ему запрещает принцип Паули. Энергия связи этого электрона невелика (5,4 эВ) и литий химически активен.
Бериллий (Be). У него четыре электрона заполняют 1s и 2s состояния, находясь в них с противоположными спинами. Электронная конфигурация бериллия 1s22s2.
От бора (B) до неона (Ne) происходит последовательное заполнение 2p состояний (n = 2, l = 1, ml = -1, 0 +1, ms = ±1/2 - всего 6 состояний).
У неона электронная конфигурация 1s22s22p6, здесь завершено заполнение оболочки с n = 2, поэтому неон, как и гелий, химически инертен.
Натрий (Na). У него одиннадцать электронов, одиннадцатый начинает новую оболочку, попадая в 3s состояние. Энергия связи этого электрона невелика (5,1 эВ) и натрий, как и литий, химически очень активен.
На этом мы остановимся. Принцип заполнения электронами состояний в первом приближении понятен из разобранных примеров. В заключении приведем схему заполнения электронами квантовых состояний первых одиннадцати атомов (рис. 9.1).

Рис. 9.1
На этой схеме стрелочками обозначены направления проекций спинов электронов на ось z. Стрелка вверх соответствует значению спинового квантового числа ms=+1/2, стрелка вниз означает, что ms=-1/2.
§ 3. Молекула
Молекула состоит из атомов, связанных друг с другом за счет валентных электронов. Квантовая механика позволяет выяснить физическую природу этой химической связи.
Молекула представляет собой связанную систему ядер и электронов, между которыми действуют электростатические силы. Кроме электростатических сил в квантово-механическом рассмотрении молекулы необходимо учитывать принцип Паули, который приводит к существованию дополнительного обменного взаимодействия.
Различают два типа связи в молекулах: ковалентную и полярную.
Ковалентная (гомеополярная) связь осуществляется за счет обобществления электронов, принадлежащих двум атомам.
Простейшей молекулой с ковалентной связью является молекула водорода. В 1927 г. немецкие физики Гайтлер и Лондон решили уравнение Шредингера для системы, состоящей из двух протонов (ядра атома водорода) и двух электронов. Оказалось, что энергия E молекулы водорода по разному зависит от расстояния r между ядрами для случаев параллельной и антипараллельной ориентации спинов электронов. График этой зависимости приведен на рисунке 9.2, из которого видно, что связанное состояние с E < 0 возможно лишь при антипараллельной ориентации спинов.
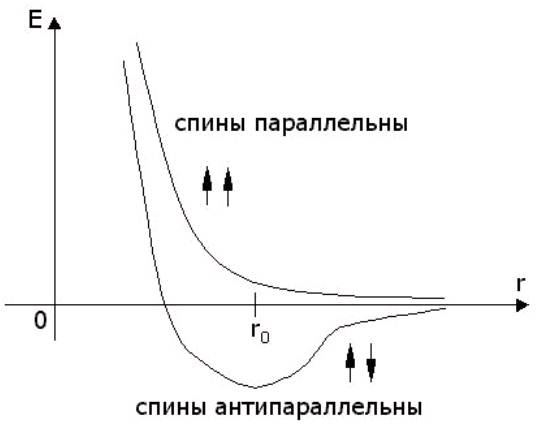
Рис. 9.2
За начало отсчета энергии молекулы E на графике принята энергия двух изолированных атомов. При r = r0 график с антипараллельными спинами имеет минимум, определяющий равновесное положение ядер в молекуле водорода. Электроны большую часть времени проводят между ядрами, таким образом, положительные ядра притягиваются к отрицательному "электронному облаку".
Ионная (гетерополярная) связь обусловлена переходом валентных электронов с одного атома на другой с образованием положительных и отрицательных ионов с электростатическим притяжением между ними.
Характерный пример ионной связи - NaCl (поваренная соль). Такого типа связь будет и у NaF. На схеме заполнения электронных состояний, приведенной в § 2 настоящей лекции (рис. 9.1) видно, что у фтора (F) не заполнено одно квантовое состояние 2p, а у натрия (Na) один валентный электрон находится в состоянии 3s, где он сравнительно слабо связан со своим атомом. Этот 3s электрон натрия и переходит в 2p состояние атома фтора. Таким образом, атом Na становится положительным ионом, а атом F - отрицательным, поэтому они и притягиваются друг к другу.
Энергия изолированной молекулы может быть приближенно представлена в следующем виде:
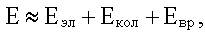
здесь Eэл - электронная энергия, она обусловлена электронной конфигурацией в молекуле;
Eкол - энергия колебания ядер относительно центра масс молекулы;
Eвр - энергия вращения ядер относительно центра масс молекулы.
Порядки величин Eэл, Eкол и Eвр следующие:
Eэл ~ 1 ÷10 эВ;
Eкол ~ 10-2 ÷10-1 эВ;
Eвр ~ 10-5 ÷10-3 эВ.
Каждая из составляющих энергии Eэл, Eкол и Eвр квантуется. Ввиду большого различия в их величинах изобразить энергетическую схему уровней молекулы в масштабе не представляется возможным. На рисунке 9.3 изображены два электронных уровня Eэл1 и Eэл2 и система колебательных и вращательных уровней.

Рис. 9.3
– Конец работы –
Эта тема принадлежит разделу:
ЛЕКЦИЯ N 1 • Краткие исторические сведения. Тепловое излучение. Излучение абсолютно черного тела. Закон Кирхгофа. Итоги лекции N 1
ЛЕКЦИЯ N Краткие исторические сведения Тепловое излучение Излучение абсолютно черного тела Закон Кирхгофа Итоги лекции N... ЛЕКЦИЯ N Проблема излучения абсолютно черного тела Формула Планка Закон... ЛЕКЦИЯ N Проблема фотоэффекта Уравнение Эйнштейна для фотоэффекта Итоги лекции N...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Спин электрона. Принцип Паули. Фермионы и бозоны.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов