рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Программирование
- /
- БУФЕРНІ РОЗЧИНИ
Реферат Курсовая Конспект
БУФЕРНІ РОЗЧИНИ
БУФЕРНІ РОЗЧИНИ - раздел Программирование, З медичної хімії Комплексоутворення в біологічних системах 1.8.1. Характерною Властивістю Буферних Систем Є: А) Постійніст...
1.8.1. Характерною властивістю буферних систем є:
а) постійність величини рН при розведенні або при додаванні невеликої кількості кислоти чи лугу;
б) незначна зміна значення рН при додаванні невеликої кількості кислоти;
в) зміна значення рН при розведенні;
г) незначна зміна рН додаванні невеликої кількості лугу.
1.8.2. Як впливає розведення буферних систем на значення рН:
а) не впливає; б) майже не змінює;
в) змінює значення рН в сторону кислого середовища;
г) змінює значення рН в сторону лужного середовища.
1.8.3. Величина рН буферних систем залежить:
а) від константи дисоціації слабкого електроліту і від співвідношення компонентів;
б) від співвідношення компонентів і температури;
в). від константи іонізації і не залежить від співвідношення компонентів;
г) від константи дисоціації і не залежить від тиску.
1.8.4. Для розрахунку рН буферного розчину необхідно знати:
а) константу дисоціації і співвідношення кислота: сіль:
б) тиск і температуру;
в) константу дисоціації і температуру;
г) співвідношення співвідношення кислота : сіль і тиск розчину.
1.8.5. рН кислотного буферу залежить від:
а) співвідношення компонентів; б) тиску;
в) температури; г) часу.
1.8.6. рН основного буферу залежить від:
а) природи речовин; б) тиску;
в) температури; г) часу.
1.8.7. Серед написаних сумішей виберіть ті, що мають буферну дію:
а) H2CO3; KHCO3; б) HNO3; NH4NO3;
в) H2CO3; NH4Cl; г) NH4OH; NaH2PO4.
1.8.8.Серед написаних сумішей виберіть ті, що мають буферну дію:
а) H2CO3; NH4Cl; б) HNO3; NH4NO3;
в) Na2HPO4; H3PO4; г)CH3COOH; CH3COONa.
1.8.9. Кислотним буфером є суміш:
а) СН3СООН і СН3СООNa б) NH4Cl і NH4OH;
в) Na2HPO4 і NaH2PO4; г) Na2CO3 і NaHCO3.
1.8.10. Основним буфером є суміш:
а) СН3СООН і СН3СООNa б) NH4Cl і NH4OH;
в) Na2HPO4 і NaH2PO4; г) Na2CO3 і NaHCO3.
1.8.11. Ацетатна буферна система представлена рівнянням:
а) СН3СООН + СН3СООNa
б) CH3COOH + NaSO4
в) CH3COOH + NaOH г) HCl + CH3COONa
1.8.12. Гідрокарбонатна буферна система представлена рівнянням:
а) H2CO3 + NaCl; б) H2CO3 + Na2CO3;
в) H2CO3 + NaHCO3; г) HCl + NaOH.
1.8.13. Ацетатний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 3,7 – 5,6; б) 6,2 – 8,2;
в) 1,3 – 3,4; г) 5,8 – 6,9.
1.8.14. Амонійний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 8,4 – 10,3; б) 5,4 – 6,8;
в) 6,8 – 8,3; г) 4,1 – 5,6.
1.8.15. Фосфатний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 5,9 – 8,0; б) 4,8 – 7,2;
в) 8,1 – 9,5; г) 3,2 – 5,8.
1.8.16. Яка із фосфатних буферних систем, що складається із 0,02 молярних розчинів Na2HPO4 i NaH2PO4 , поданих нище, має значення рН=6,81:
а) 40 мл Na2HPO4 та 40 мл NaH2PO4;
б) 10 мл Na2HPO4 та 20 мл NaH2PO4;
в) 20 мл Na2HPO4 та 30 мл NaH2PO4;
г) 25 мл Na2HPO4 та 40 мл NaH2PO4.
1.8.17. Ацетатна буферна система, яка відповідає значенню рН=4,65 складається з 0,01 молярних розчинів СН3СООН і СН3СООNa, які подані у об’ємах:
а) 20 мл СН3СООН та 20 мл СН3СООNa; б) 10 мл СН3СООН та 25 мл СН3СООNa;
в) 30 мл СН3СООН та 15 мл СН3СООNa; г) 20 мл СН3СООН та 10 мл СН3СООNa.
1.8.19 При якому співвідношенні кислота : сіль рН кислотної буферної системи найбільший:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.20. При якому співвідношенні кислота : сіль рН кислотної буферної системи найменший:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.21. При якому співвідношенні кислота : сіль рН аміачної буферної системи буде найбільша:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.22. При якому співвідношенні кислота : сіль рН аміачної буферної системи буде найменша:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.23. Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти чи лугу:
а) електролітична дисоціація, протоліз, нейтралізація;
б) електролітична дисоціація, протоліз, гідроліз;
в) гідроліз, протоліз, нейтралізація;
г) окислення, гідроліз, протоліз.
1.8.24. Механізм дії буферних систем направлений на:
а) відновлення кислих і лужних продуктів;
б) окиснення кислих і лужних речовин;
в) нейтралізацію кислих і лужних продуктів;
г) гідроліз кислих і лужних продуктів.
1.8.25. Механізм дії на ацетатну буферну систему кислотою представлений в рівнянні:
а) СН3СОО- + Н3О+ ↔ СН3СООН + Н2О;
б) NН3∙H2O + H3O+ ↔ NH4+ + 2H2O;
в) H3O+ + HCO3- ↔ H2CO3 + H2O;
г) H3O+ + OH- ↔ 2H2O.
1.8.26. Механізм дії на амонійну буферну систему лугу представлений рівнянням:
а) OH- + H3O+ ↔ 2H2O;
б) NН3 ∙ H2O + H3O+ ↔ NH4+ + 2H2O;
в) OH- + HCO3- ↔ HCO3- + H2O
г) OH- + NH4+ ↔ NH3 ∙ H2O.
1.8.27. Механізм дії на гідрокарбонатну буферну системукислотою представлений в рівнянні:
а) Нb- + H3O+↔HHb + H2O;
б) H3O+ + OH- ↔ 2H2O;
в) HPO4-2 + H3O+ ↔ H2PO4- + H2O;
г) H3O+ + HCO3- ↔ H2CO3 + H2O.
1.8.28. Механізм дії на гідрокарбонатну буферну систему кислотою представлений рівнянням:
а) H3O+ + HCO3- ↔ H2CO3 + H2O;
б) НСО-3 + OH- ↔ H2CO3
в) H2CO3 + OH- ↔ HCO-3 + H2O
г) H3O+ + OH- ↔ 2H2O.
1.8.29. Механізм дії на фосфатну буферну систему кислотою представлений:
а) НРО4-2 + Н3О+ ↔ Н2РО4- + Н2О
б) НРО4- + Н3О+ ↔ Н3РО4- + ОН-
в) Н2РО4- + ОН- ↔ НРО4-2 + Н2О+
г) НРО4-2 + Н2О+ ↔ Н2РО4- + ОН-.
1.8.30. Рівняння Гендерсона для підрахунку рН кислотних буферних систем:
а) 
б) 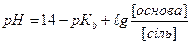
в) 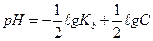
г)
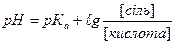
1.8.31. Рівняння Гендерсона для підрахунку рН основних буферних систем:
а) 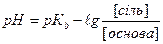
б) 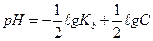
в) 
г) 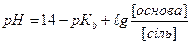
1.8.32. Для розрахунку рН основного буферу необхідно скористатись формулою:
а) 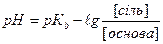
б) 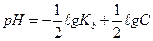
в) 
г) 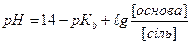
1.8.33. Біохімічні буферні системи організму:
а) гідрокарбонатна, фосфатна, гемоглобінова, білкова;
б) фосфатна, ацетатна, білкова, гідрокарбонатна;
в) гемоглобінові, білкова, фосфатна, амонійна;
г) білкова, ацетатна, амонійна, фосфатна.
1.8.34. Буферна дія – це здатність буферного розчину стійко зберігати сталу величину :
а) молярних концентрацій компонентів; б) рН;
в) константи дисоціації слабкого електроліту.
1.8.35.Склад буферних систем кислотного типу:
а) сильна кислота та основа;
б) слабка кислота та її сіль, що утворена сильною основою;
в) сильна кислота та її сіль, що утворена сильною основою.
1.8.36.Склад ацетатного буферу:
а) СН3СООН + СН3СООС2Н5;
б) СН3СООН + NaOH;
в) СН3СООН + СН3СООNa.
1.8.37.Склад гідрогенкарбонатного буферу:
а) H2CO3 + NaHCO3; б) H2CO3 + NаCl; в) NaHCO3 + NаCl.
1.8.38.Співвідношення компонентів гідрогенкарбонатного буферу в плазмі крові за
рН = 7,36 має бути:
а) 15 : 1; б) 20 : 1; в) 7 : 1; г)4 :1.
1.8.39.Склад фосфатного буфера:
а) Na3PO4 + NaH2PO4;
б) Na2 НPO4 + NaH2PO4;
в) Н3PO4 + NaH2PO4.
г) Н3PO4 + Na2PO4.
1.8.40. Співвідношення компонентів фосфатного буферу в плазмі крові за рН= 7,36 має бути:
а) 8 : 1; б) 10 : 1; в) 4 : 1.
1.8.41. Склад білкового буфера:
а) PtCOOH + PtCOOK;
б) PtCOOH + PtCONH2;
в) PtCOOH +( PtCOO)2Ca.
1.8.42. Формула білкової молекули як буфера:
а) Pt - COOH б) Pt - COOК
NH2 NH2
в) Pt - COCl г) Pt - COOH
NH2 NО2
1.8.43.Склад гемоглобінового буфера:
а) HHb + KHbО2; б) HHb + KHb;
в) HHb + NaHbО2.
1.8.44.Склад оксигемоглобінового буфера:
а) HHb + Са(HbО2)2; б) HHb + KHb; в) HhbО2 + КHbО2.
1.8.45.Склад буферних систем основного типу:
а) сильна кислота та слабка основа;
б) слабка основа та її сіль, що утворена сильною кислотою;
в) сильна кислота та її сіль, що утворена сильною основою.
1.8.46.Склад аміачного буфера:
а) NH4OH + NH4Cl; б) NH4OH + HCl; в) NH4NO3 + HNO3.
1.8.47. рН буферних систем залежить від:
а) величини КД та співвідношення компонентів;
б) величини КД та добутку компонентів;
в) величини КД та суми компонентів;
г) різниці компонентів.
1.8.48.Кислотно-лужна рівновага – це сталість в організмі людини величини:
а) осмотичного тиску;
б) артеріального тиску;
в) рН.
г) рОН.
1.8.49.Які органи та тканини підтримують кислотно-лужну рівновагу:
а) серце, шкіра, кістки; б) легені, нирки, кров; в) легені, зубна тканина, нирки.
1.8.50.Легені підтримують кислотно-лужну рівновагу в організмі людини:
а) виводячи воду;
б) виводячи вуглекислий газ;
в) виводячи солі.
г) виводячи кислоти.
1.8.51.Яка із буферних систем міститься у крові ?
а) CH3COOH б) R - COOH
СH3COONa
NH2
в) NH4OH г) Na2CO3
NH4NO3 Na2SO4
1.8.52.Механізм дії фосфатного буферу в крові:
а) NaН2PO4+НCl → Н3РО4+NaCl;
б) Na2HPO4+ NaOН → Na3PO4 +Н2О;
в) Na2HPO4 + НCl → NaH2PO4+NaCl.
1.8.53.Механізм дії гідрогенкарбонатного буферу в крові :
а) NaHСO3 + NaOH → Na2СO3 + H2O; б) NaHСO3 + НCl → NaCl + H2СO3;
в) NaHСO3 + NaOH → Н2СO3 + H2O.
1.8.54. Рівняння обчислення рН гідрогенкарбонатного буферу
А)  ;
;
Б) 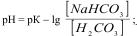
В) 
1.8.55. Формула обчислення рН для фосфатного буферу:
а)  ;
;
Б)  ;
;
В) 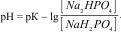
Г) –рК.
– Конец работы –
Эта тема принадлежит разделу:
З медичної хімії Комплексоутворення в біологічних системах
з медичної хімії Комплексоутворення в біологічних системах... для студентів спеціальностей Лікувальна справа та Педіатрія... Рівень...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: БУФЕРНІ РОЗЧИНИ
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов