рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Программирование
- /
- БУФЕРНА ЄМНІСТЬ.
Реферат Курсовая Конспект
БУФЕРНА ЄМНІСТЬ.
БУФЕРНА ЄМНІСТЬ. - раздел Программирование, З медичної хімії Комплексоутворення в біологічних системах 1.9.1. Буферна Ємність Це Розрахункова Величина: А) Визначаєтьс...
1.9.1. Буферна ємність це розрахункова величина:
а) визначається молярною масою еквівалента сильної кислоти, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
б) визначається кількістю еквівалентів сильної кислоти або сильної основи, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
в) визначається молярною масою еквівалента сильної основи, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
г) визначається кількістю еквівалентів сильної кислоти або сильної основи, що треба додати до 1 л буферного розчину, щоб рН залишився сталим.
1.9.2. На буферну ємність розчинів впливають:
а) константа дисоціації і температура;
б) співвідношення концентрації компонентів і тиск;
в) концентрація буферного розчину і співвідношення концентрації компонентів даного розчину;
г) константа дисоціації і природа буферного розчину.
1.9.3.На буферну ємкість розчинів впливають:
а) константа дисоціації і природа буферного розчину;
б) концентрація буферного розчину і співвідношення концентрації компонентів даного розчину.
в) співвідношення концентрації компонентів і тиск;
г) константа дисоціації і температури.
1.9.4. На скільки одиниць змінюється рН буферного розчину при розрахунку його буферної ємності:
а) 1; б) 2; в) 3; г) 0,5.
1.9.5. Буферну ємність розраховують за об’ємом буферного розчину:
а) 1 дм3; б) 1 см3; в) 1 м3; г) 1 мл.
1.9.6. Найбільшу буферну ємність має буферний розчин, якщо співвідношеним між кислотою і основою є:
а) більше кислоти; б) менше кислоти;
в) більше основи; г) менше основи;
д) однакові.
1.9.7. Найбільшу буферну ємність за кислотою має буферний розчин, в якому співвідношення кислоти і солі є:
а) більше кислоти; б) більше солі;
в) однаково; г) менше кислоти.
1.9.8. Розрахунок буферної ємності можна провести за:
а) кислотою і водою; б) кислотою і сіллю;
в) кислотою і основою; г) основою і сіллю.
1.9.9. Величину буферної ємності за кислотою розраховують:
а) 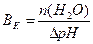 ; б)
; б) 
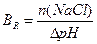 ;
;
в) 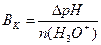 ; г)
; г) 
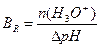 .
.
1.9.10. Величину буферної ємності за основою розраховують:
а)  ; б)
; б) 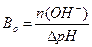 ;
;
в) 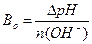 ; г)
; г)  .
.
1.9.11. Найбільшу буферну ємність має буферний розчин, якщо співвідношеним між кислотою і основою є:
а) більше кислоти; б) менше кислоти; в) однакові; г) менше основи; д) більше основи.
1.9.12. У плазмі крові найбільшу роль відіграють буферні системи:
а) аміачна; б) гідрокарбонатна;
в) ацетатна; г) гемоглобінна.
1.9.13. У плазмі крові найбільшу роль відіграють буферні системи:
а) фосфатна; б) гемоглобінова;
в) аміачна; г) ацетатна.
1.9.14. У еритроцитах переважає буферна система:
а) фосфатна; б) гемоглобінова;
в) аміачна; г) ацетатна.
1.9.15. Які функціональні групи білкових молекул зумовлюють їх буферну дію?
а) –СООН; -NO2; б) –СООН; -NН2;
в) -NН2; -CN; г) -NН2; -NO2.
1.9.16.Механізм дії буферних систем направлений на:
а) нейтралізацію кислих і лужних продуктів;
б) відновлення кислих і лужних продуктів;
в) гідроліз кислих і лужних продуктів;
г) окиснення кислих і лужних речовин.
1.9.17. Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти:
а) гідроліз, протоліз, нейтралізація;
б) окислення, гідроліз, протоліз;
в) електролітична дисоціація, протоліз, нейтралізація;
г) електролітична дисоціація, протоліз, гідроліз.
1.9.18. Механізм дії гідрокарбонатної буферної системипри надходженні лужних продуктів представлений рівнянням:
а) Н3О+ + НСО3- ↔ Н2СО3 + Н2О
б) Н3О+ + ОН- ↔ 2 Н2О
в) Н2СО3 + ОН- ↔ НСО3- + Н2О
г) Н2СО3 + Н2О ↔ НСО3- + Н3О+
1.9.19. Механізм дії на гідрокарбонатну буферну систему кислотою представлений рівнянням:
а) Н3О+ + ОН- ↔ 2Н2О
б) Н2СО3 + ОН- ↔ НСО3- + Н2О
в) Н3О+ + НСО3-↔ 2 Н2О
г) Н2СО3 + Н2О ↔ НСО3- + Н3О+
1.9.20. Кислотно-основна рівновага крові визначається:
а) величиною рН, концентрацією йонів НСО3-, тиском СО2 в крові;
б) величиною рН, концентрацією йонів ОН-, тиском СО2 в крові;
в) величиною рН, температурою, концентрацією йонів ОН-;
г) концентрацією йонів Н3О; ОН-, температурою.
1.9.21. Лужний резерв крові вимірюється:
а) об’ємом СО2; б) об’ємом СО;
в) Об’ємом НО2; г) Об’ємом NО2.
1.9.22. При якому співвідношенні НСО3-:Н2СО3 рН гідрокарбонатного буферу відповідає рН крові:
а) 20:1; б) 15:1; в) 1:1; г) 1:20.
1.9.23. Механізм дії буферної системи оксигемоглобін-гемоглобін при надходженні кислих продуктів представлений рівнянням:
а) ННb + OH- ↔ Hb- + H2O
HHbO2 + OH- ↔ HbO2- + H2O;
б) Hb- + H3O+ ↔ ННb + H2O
HbO2- + H3O+ ↔ HHbO2 + H2O;
в) Hb- + H2O ↔ ННb + OH-
HbO2- + H2O ↔ HHbO2 + OH-;
г) Hb- + Н2СО3 ↔ HHbO2 + НСО3-
HbO2- + Н2СО3 ↔ HHbO2 + НСО3-.
1.9.24. Буферна система оксигемоглобін-гемоглобін характеризується рівновагою між йонами:
а) Hb- і ННb б) Hb- і OH-
HbO2- і HHbO2; HbO2- і OH-;
в) Hb- і H3O+ г) Hb- і HHbO2
HbO2- і H3O+; HbO2- і ННb.
1.9.29. Значення рН плазми крові в нормі може знаходитись:
а) 7,35-7,45; б) 6,80-7,0;
в) 7,15-7,35; г) 8,01-8,35.
1.9.30. Зрушення кислотно-основного стану крові у сторону підвищення концентрації йонів водню (зниження рН) називають:
а) алкалозом; б) анабіозом;
в) ацидозом; г) антагонізмом.
1.9.31. Зрушення кислотно-основного стану крові у сторону зменшення концентрації йонів водню (підвищення рН) називають:
а) ацидозом; б) алкалозом;
в) анабіозом; г) антагонізмом.
1.9.32. Яку із наведених речовин можна використовувати для коригування кислотно-основного стану організму при ацидозі:
а) NaHCO3; б) NaCl
в) HCl г) аскорбінову кислоту.
1.9.33. Механізм дії білкової буферної системи при надходженні кислих продуктів представлений рівняням:
а) 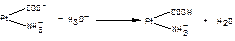 ;
;
б) 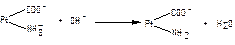 ;
;
в) 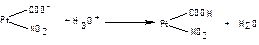 ;
;
г)  ;
;
1.9.34. Механізм дії на фосфатну буферну систему кислотою представлений рівнянням:
а) НРО4-2 + Н2О ↔ Н2РО4- + ОН-;
б) Н2РО4- + ОН- ↔ НРО4-2 + Н2О;
в) НРО4-2 + Н3О ↔ Н3РО4 + ОН-;
г) НРО4-2 + Н3О ↔ Н2РО4- + Н2О.
1.9.35.Буферна ємкість – це кількість моль екв. сильної кислоти або лугу, яку необхідно додати до:
а) 1мл буферної системи, щоб змінити рН на 1;
б) 10л буферної системи, щоб змінити рН на 1;
в) 1л буферної системи, щоб змінити рН на 1.
1.9.36.Буферна ємкість – це кількість моль екв. сильної кислотабо лугу, яку необхідно додати до 1л буферної системи, щоб змінити рН на:
а) 2; б) 1; в) 10.
HHbO2 + OH- ↔ HbO2- + H2O
– Конец работы –
Эта тема принадлежит разделу:
З медичної хімії Комплексоутворення в біологічних системах
з медичної хімії Комплексоутворення в біологічних системах... для студентів спеціальностей Лікувальна справа та Педіатрія... Рівень...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: БУФЕРНА ЄМНІСТЬ.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов