рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Программирование
- /
- КОЛІГАТИВНІ ВЛАСТИВОСТІ. ОСМОС
Реферат Курсовая Конспект
КОЛІГАТИВНІ ВЛАСТИВОСТІ. ОСМОС
КОЛІГАТИВНІ ВЛАСТИВОСТІ. ОСМОС - раздел Программирование, З медичної хімії Комплексоутворення в біологічних системах 1.10.1. Дифузія – Це Процес: А...
1.10.1. Дифузія – це процес:
а) переміщення частинок речовини з зони більшої концентрації в меншу до вирівнювання концентрації;
б) переміщення частинок речовини з зони меншої концентрації в більшу до вирівнювання концентрації;
в) переходу речовини із твердого стану в рідкий;
г) переходу речовини із рідкого стану в газоподібний;
д) переходу речовини із одного стану в інший;
1.10.2. Осмос – це процес:
а) переміщення частинок речовини з зони більшої концентрації в меншу до вирівнювання концентрації;
б) переміщення частинок речовини з зони більшої концентрації в меншу до вирівнювання концентрації через напівпроникну мембану;
в) переміщення частинок речовини з зони меншої концентрації в більшу до вирівнювання концентрації;
г) переміщення частинок речовини з зони меншої концентрації в більшу до вирівнювання концентрації через напівпроникну мембрану.
Розчинність газів в розчині:
а) тим менша, чим більша концентрація розчинених в розчині солей;
б) тим більша, чим менша концентрація розчинених в розчині солей;
в) не залежить від концентрації розчинених солей;
г) прямо пропорційна концентрації розчинених солей;
д) обернено пропорційна концентрації розчинених солей.
1.10.3. Розчинність газів в рідині:
а) прямо пропорційна тиску газу;
б) обернено пропорційна тиску газу;
в) не залежить від тиску газу;
г) зменшується зі збільшенням тиску;
д) збільшується зі зменшенням тиску.
1.10.4. Кесонна хвороба виникає через:
а) збільшення розчинності газів при зростанні тиску і зменшення розчинності газів в крові при зменшенні тиску;
б) зменшення розчинності газів при зростанні тиску і збільшення розчинності газів в крові при зменшенні тиску;
в) збільшення розчинності газів при зменшенні тиску і зменшення розчинності газів в крові при збільшенні тиску;
г) збільшення розчинності газів при зменшенні тиску і зменшення розчинності газів в крові при зменшенні тиску.
1.10.5. «Гірська хвороба» виникає через:
а) збільшення розчинності газів при зростанні тиску і зменшення розчинності газів в крові при зменшенні тиску;
б) зменшення розчинності газів при зростанні тиску і збільшення розчинності газів в крові при зменшенні тиску;
в) збільшення розчинності газів при зменшенні тиску і зменшення розчинності газів в крові при збільшенні тиску;
г) збільшення розчинності газів при зменшенні тиску і зменшення розчинності газів в крові при зменшенні тиску.
1.10.6. Осмосом називається процес переходу через напівпроникну мембрану молекул розчинника:
а) із 2 % р-ну NaCl в 10 % р-н NaCl;
б) із 10 % р-ну NaCl в 2 % р-н NaCl;
в) із 5 % р-ну NaCl в 5 % р-н NaCl;
г) із 10 % р-ну NaCl в 10 % р-н NaCl;
д) із 0,9 % р-ну NaCl в 5 % р-н глюкози.
1.10.7. Осмотичний тиск вимірюється в:
а) кПа; б) кДж/моль; в) Па/л;
г) атм/моль; д) Па/моль.
1.10.8. Осмотичний тиск плазми крові рівний:
а) 740-780 кПа; б) 730-750 кПа;
в) 800-850 кПа; г) 700-800 кПа;
д) 720-760 кПа.
1.10.9. Ізотонічним називається розчин, що має значення осмотичного тиску:
а) рівний значення стандарту;
б) вищий значенню стандарту;
в) нищий значення стандарту;
г) нижчий значення тиску крові;
д) вищий значенню тиску крові;
1.10.10. Ізотонічним до плазми крові є розчин:
а) 4,5 %-ий глюкози; б) 4,5 %-ий NaCl;
в) 0,45 %-ий глюкози; г) 0,9 %-ий глюкози.
1.10.9. Гіпотонічним називається розчин, що має значення осмотичного тиску:
а) рівний значення стандарту;
б) вищий значенню стандарту;
в) нищий значення стандарту;
г) нижчий значення тиску крові;
д) вищий значенню тиску крові;
1.10.9. Гіпертонічним називається розчин, що має значення осмотичного тиску:
а) рівний значення стандарту;
б) вищий значенню стандарту;
в) нищий значення стандарту;
г) нижчий значення тиску крові;
д) вищий значенню тиску крові;
1.10.11. Із наведених нижче розчинів гіпертонічним є:
а) 5 % р-н глюкози; б) 0,1 % NaCl;
в) 1,0 % р-н глюкози; г) 10 % NaCl.
1.10.12. Еритроцит вміщений в 0,5 % розчин NaCl. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) екзоосмосу; г) дифузії;
д) осмос не проходить.
1.10.13. Еритроцит вміщений в 0,9 % розчин NaCl. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) екзоосмосу; г) дифузії;
д) осмос не проходить.
1.10.14. Еритроцит вміщений в 5 % розчин NaCl. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) ендоосмосу; г) дифузії;
д) осмос не проходить.
1.10.15. Еритроцит вміщений в 10 % розчин NaCl. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) ендоосмосу; г) дифузії;
д) осмос не проходить.
1.10.16. Еритроцит вміщений в 0,9 % розчин глюкози. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) екзоосмосу; г) дифузії;
д) осмос не проходить.
1.10.17. Еритроцит вміщений в 5 % розчин глюкози. При цьому протікає процес:
а) гемолізу; б) плазмолізу;
в) ендоосмосу; г) дифузії;
д) осмос не проходить.
1.10.18. Еритроцит помістили в дистильовану воду. При цьому відбуваються процеси:
а) набухання і розтріскування;
б) всихання і зморщування;
в) нічого не відбувається;
г) поглинання води еритроцитом;
д) виділення води еритроцитом.
1.10.19. Еритроцит помістили в 2% розчин CuCl2. При цьому відбуваються процеси:
а) набухання: розтріскування;
б) всихання і зморщування;
в) нічого не відбувається;
г) поглинання води еритроцитом;
д) виділення води еритроцитом.
1.10.20. Порівняйте осмотичний тиск розчинів NaCl і глюкози однаковї молярної концентрації:
а) більший в NaCl; б) менший в NaCl;
в) однакові; г) менший в глюкози;
д) більший в глюкози.
1.10.21.В 1 л розчину, який ізотонічний до плазми крові може бути глюкози:
а) 0,303 моля; б) 0,205 моля;
в) 0,154 моля; г) 0,148 моля;
д) 0,284 моля.
1.10.22. Порівняйте осмотичний тиск розчинів MgCl2 і NaCl однакових молярних концентрацій:
а) більший в MgCl2; б) більший в AgCl;
в) менший в MgCl2; г) однаковий;
д) менший в AgCl.
1.10.23. Порівняйте осмотичний тиск розчинів сахарози і Na3PO3 однакових молярних концентрацій:
а) більший в сахарозі; б) однаковий;
в) більший в Na3PO3; г) менший в сахарозі;
д) менший в Na3PO3.
1.10.24. Порівняйте осмотичний тиск розчинів NaBr і NaCl однакових молярних концентрацій:
а) більший в NaBr; б) однаковий;
в) менший в NaBr; г) більший в NaCl;
д) менший в NaCl.
1.10.25. Температура замерзання розчину в порівнянні із температурою замерзання чистого розчинника:
а) понижується; б) підвищується;
в) не змінюється;
г) понижується, а потім підвищується;
д) підвищується, а потім понижується.
1.10.26. Температура кипіння розчину в порівнянні із температурою кипіння чистого розчинника:
а) понижується; б) підвищується;
в) не змінюється;
г) понижується, а потім підвищується;
д) підвищується, а потім понижується.
1.10.27. Депресією температури замерзання розчину називають:
а) пониження температури замерзання;
б) підвищення температури замерзання;
в) пониження тиску; г) підвищення тиску;
д) зміна температури.
1.10.28. Визначення молярної маси розчиненого у воді неелектроліту через визначення температури замерзання його розчину називається:
а) кріометрією; б) ебуліометрією;
в) кріоскопією; г) осмометрією.
1.10.29. Визначення молярної маси розчиненого у воді неелектроліту через визначення температури кипіння його розчину називається:
а) кріометрією; б) ебуліоскопією;
в) кріоскопією; г) осмометрією.
1.10.30. Кількісно величину осмотичного тиску розчиненого у воді неелектроліту можна визначити законом Вант-Гоффа за формулою:
а) π=CRT б) π=iCRT в) Δp=po x2
г) 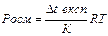 д)
д) 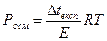
1.10.31. Кількісно величину осмотичного тиску розчиненого у воді електроліту можна визначити законом Вант-Гоффа за формулою:
а) π=CRT б) π=iCRT в) Δp=po x2
г) 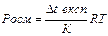 д)
д) 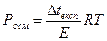
1.10.32. Кріоскопічна постійна К визначається як величина пониження температури замерзання розчину, що містить:
а) 1 моль розчиненої речовини в 1 кг розчинника;
б) 1 моль розчиненої речовини в 1 л розчинника;
в) 0,1 моль розчиненої речовини в 1 кг розчинника;
г) 1 моль розчиненої речовини в 100 г розчину;
д) 0,1 моль розчиненої речовини в 1 кг розчину.
1.10.33. Зв’язок ізотонічного коефіцієнту зі ступенем дисоціації:
а) і = 1 – α ( n – 1 ) ; б) і = 1 + α ( n – 1 ) ;
в) і = 1 + α ( n + 1 ).
1.10.34. Гіпотонічним називають розчин, осмотичний тиск якого:
а) менший за Росм другого розчину;
б) однаковий із Росм другого розчину;
в) більший за Росм другого розчину.
1.10.35.Ізотонічним називається розчин осмотичний тиск якого:
а) менший за Росм другого розчину;
б) однаковий із Росм другого розчину;
в) більший за Росм другого розчину.
1.10.36.Гіпертонічним називається розчин осмотичний тиск якого:
а) менший за Росм другого розчину;
б) однаковий із Росм другого розчину;
в) більший за Росм другого розчину.
1.10.37.В медицині використовують ізотонічний розчин NaCl з масовою часткою його:
а) 1%; б) 0,5%; в) 0,9%.
1.10.38.Фізіологічним або ізотонічним розчином назвають:
а) 0,9% розчин Na2SO4; б) 0,9% розчин NaCl;
в) 0,9% розчин NaNO3;
1.10.39.В медицині використовують гіпертонічний розчин NaCl з масовою часткою його:
а) 1%; б) 10%; в) 0,9%.
1.10.40.Ізоосмія – це :
а) сталість рН; б) сталість артеріального тиску;
в) сталість осмотичного тиску.
1.10.41.Величина осмотичного тиску крові:
а) 22,4 атм; б) 7,36 атм;
в) 8,7 атм; г) 7,5 атм.
1.10.42.Осмотична концетрація крові:
а) 1 моль/л; б) 0,303 моль/л; в) 0,7 моль/л.
1.10.43.Ізоосмія в організмі людини підтримується:
а) нирками та легенями; б) кістками та шкірою;
в) мозком та печінкою.
1.10.44.Ізоосмія в організмі людини підтримується:
а) печінкою та підшкірною клітковиною;
б) кістками та шкірою;
в) мозком та печінкою.
1.10.45.Гемоліз це:
а) зморщування клітин в гіпотонічному розчині;
б) руйнування клітини в гіпотонічному розчині;
в) сталий стан клітини.
г) зморщування клітин в гіпертонічному розчині.
1.10.46.Плазмоліз це:
а) збільшення клітини в об’ємі;
б) зморщування клітини в гіпертонічному розчині;
в) руйнування клітини в гіпотонічному розчині.
1.10.47.Під час гемолізу осмос направлений:
а) з клітини; б) осмос зупиняється; в) у клітину.
1.10.48.Під час плазмолізу осмос напралений:
а) з клітини; б) осмос зупиняється; в) у клітину.
1.10.49.Онкотичний тиск крові становить:
а) 1 атм; б) 4 атм; в) 0,04 атм.
1.10.50.Онкотичний тиск крові обумовлений:
а) електролітами; б) білками; в) неелектролітами.
1.10.51.Послаблююча дія 25 %-ного розчину МgSO4 пояснюється тим що це:
а) ізотонічний розчин; б) гіпертонічний розчин;
в) гіпотонічний розчин.
1.10.52.Що відбувається, якщо річкову рибу пустити в море?
а) гемоліз; б) плазмоліз; в) нічого не трапиться.
1.10.53.Чи ізотонічні 1М розчини сечовини і оцтової кислоти :
а) ізотонічні; б) гіпотонічний розчин сечовини;
в) гіпертонічний розчин сечовини.
1.10.54.Потреба організму відновити осмотичний тиск до норми зумовлюється відчуттям :
а) голоду; б) спраги; в) сну.
1.10.55.Коли в організм вводиться з їжею велика кількість цукру або солі осмотичний тиск :
а) знижуються б) не змінюється; в) підвищується.
1.10.56.Що відбувається, якщо морську рибу пустити в річку?
а) тургор; б) явище плазмолізу; в) явище гемолізу.
1.10.57.Плазмоліз клітин спостерігається:
а) РОСМ зовні > РОСМ в середині;
б) РОСМ зовні = РОСМ в середині;
в) РОСМ зовні < РОСМ в середині.
1.10.58.Тиск насиченої пари над розчином в порівнянні з тском насиченої пари над чистим розчинником:
а) більший; б) менший;
в) однаковий. г) не змінюється.
1.10.59.Розчини замерзають за температури:
а) 0°С; б) вище 0°С; в) нижче 0°С.
1.10.60 Зниження температури замерзання розчину ∆t це різниця між температурою замерзаня
води та:
а) температурою замерзання розчиненої речовини;
б) температурою замерзання розчину;
в) температурою замерзання води та кріоскопічною константою.
1.10.61. Температура замерзання електролітів порівняно із неелектролітами за однакової молярної
концентрації:
а) вища; б) нижча;
в) однакова; г) залежить від розчинника.
1.10.62. Електроліти замерзають за нижчої температури порівняно із неелектролітами, тому що
електроліти:
а) дисоціюють; б) не дисоціюють;
в) випаровуються.
1.10.63. Зниження тиску насиченої пари тим більше, чим:
а) нижча концентрація; б) вища концентрація;
в) не залежить.
1.10.64. Гіпотонічні розчини лікарських засобів не можна вводити внутрішньовенно тому, що відбувається:
а) гемоліз еритроцитів;
б) плазмоліз еритроцитів;
в) збільшення осмотичного тиску крові;
г) зсідання еритроцитів
1.10.65. До колігативних властивостей розчинів відносять
а) осмос і осмотичний тиск ;
б) седиментаційну стійкість ;
в) кінетичну стійкість ;
г)ефект Тіндаля.
1.10.66. Під час перебування в гірський місцевості у людини можуть розвинутись симптоми гіпоксії. Вплив якого фактору зумовлює появу таких симптомів:
а) зменшення парціального тиску кисню;
б) зменшення парціального тиску азоту;
в) зменшення атмосферного тиску;
г)збільшення атмосферного тиску.
1.10.67. Напівпроникна мембрана пропускає молекули:
а) розчину; б) розчинника;
в) розчиненої речовини.
1.10.68. .Приклади природних напівпроникних мембран:
а) целофан; б) поліетилен;
в) мембрана рослинних клітин.
1.10.69. Приклади штучних напівпроникних мембран:
а) целофан; б) поліетилен; в) папір.
1.10.70. Осмотичний тиск вимірюють:
а) сталагмометром;
б) осмометром;
в) віскозиметром.
1.10.71. Осмотичний тиск електроліту більший за осмотичний тиск неелектроліту за однакової
молярної концентрації тому що:
а) електроліти не дисоціюють; б) електроліти дисоціюють;
в) тому що кількість кінетичних частинок однакова.
1.10.72. Осмотична концентрація електроліту в порівнянні з осмотичною концентрацією
неелектроліту за однакової молярної концентрації більша тому що:
а) електроліти не дисоціюють; б) електроліти дисоціюють;
в) тому що кількість кінетичних частинок однакова.
1.10.73. Ізотонічний коефіцієнт i показує:
а) на скільки Росм. електроліту більший за Росм. неелектроліту;
б) у скільки разів Росм. електроліту більший за Росм. неелектроліту за однакової молярної
концентрації;
в) у скільки разів Росм. електроліту менший за Росм. неелектролітуза однакової молярної
концентрації.
1.10.74. Зв’язок ізотонічного коефіцієнту зі ступенем дисоціації:
а) і = 1 – α ( n – 1 ) ; б) і = 1 + α ( n – 1 ) ;
в) і = 1 + α ( n + 1 ).
1.10.75. Гемоліз це:
а) зморщування клітин в гіпотонічному розчині;
б) руйнування клітини в гіпотонічному розчині;
в) сталий стан клітини.
1.10.76. Плазмоліз це:
а) збільшення клітини в об’ємі; б) зморщування клітини в гіпертонічному розчині;
в) руйнування клітини в гіпотонічному розчині.
1.10.77. Онкотичний тиск крові обумовлений:
а) електролітами; б) білками; в) неелектролітами.
1.10.78. Плазмоліз клітин спостерігається:
а) РОСМ зовні > РОСМ в середині;
б) РОСМ зовні = РОСМ в середині;
в) РОСМ зовні < РОСМ в середині.
1.10.79. Тиск насиченої пари над розчином в порівнянні з тском насиченої пари над чистим
розчинником:
а) більший; б) менший; в) однаковий.
1.10.80. Рідина закіпає, якщо тиск її насиченої пари :
а) дорівнює атмосферному тиску;
б) більший за атмосферний тиск;
в) менший за атмосферний тиск.
1.10.81. Підвищення температури кипіння розчинів залежить від:
а) концентрації; б) об’єму; в) температури.
– Конец работы –
Эта тема принадлежит разделу:
З медичної хімії Комплексоутворення в біологічних системах
з медичної хімії Комплексоутворення в біологічних системах... для студентів спеціальностей Лікувальна справа та Педіатрія... Рівень...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: КОЛІГАТИВНІ ВЛАСТИВОСТІ. ОСМОС
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов