рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Программирование
- /
- СИТУАЦІЙНІ ЗАДАЧІ
Реферат Курсовая Конспект
СИТУАЦІЙНІ ЗАДАЧІ
СИТУАЦІЙНІ ЗАДАЧІ - раздел Программирование, З медичної хімії Комплексоутворення в біологічних системах 3.1. При Клінічному Дослідженні Шлункового Соку Визначен...
3.1. При клінічному дослідженні шлункового соку визначено його рН= 0,8. Розрахувати:
1) Дане значення рН для шлункового соку відповідає за кислотність:
а) понижену; б) підвищену;
в) нульову; г) алкалоз.
2)Яка концентрація йонів водню в цьому шлунковому соці?
а) 2,24 ∙ 10-2; б) 1,41 ∙ 10-2;
в) 2,16 ∙ 10-3; г) 1,58 ∙ 10-1.
3) Яка концентрація гідроксид-йонів в цьому соці?
а) [ОН-] = 2,23∙10-6; б) [ОН-] = 6,28∙10-8;
в) [ОН-] = 6,33∙10-14; г) [ОН-] = 7,08∙10-13.
4) Для зниження кислотності шлункового соку використовують розчин?
а) 5% NaHCO3; б) 5% глюкози;
в) 2% CuSO4; г) 0,9% NaCl.
5) Як зміниться величина рН даного шлункового соку коли до 10 мл його додати 10 мл розчину NaOH з концентрацією С=0,01 моль/ л?
а) збільшиться; б)зменшиться;
в) не зміниться; г) різко зменшиться.
3.2. Розчин хлориду кальцію застосовується в медицині як кровоспинний і протиалергічний засіб:
1) Розрахувати молярну концентрацію розчину хлориду кальцію, що містить в 100мл розчину 5 г CaCl2 ∙ 6H2O:
а) 0,456 моль/л; б) 0,228 моль/л;
в) 0,034 моль/л; г) 0,023 моль/л.
2) Визначте масу катіонів кальцію, що поступають в організм при вживанні в середину столової ложки (15 мл) розчину, що містить в 100мл розчину 5 г CaCl2 ∙ 6H2O
а) 0,14 г; б) 0,07 г;
в) 0,28 г; г) 1,28 г.
3) Який ізотонічний коефіцієнт необхідно прийняти в розрахунку осмотичного тиску даного розчину?
а) 1; б) 2; в) 3; г) 4.
4) Розрахуйте осмотичний тиск, який створює даний розчин?
а) 1804 кПа; б) 7501 кПа;
в) 3570 кПа; г) 1763 кПа.
5) Цей розчин є:
а) ізотонічний; б) гіпертонічний;
в) гіпотонічний; г) фізіологічний
3.3. В людському організмі в загальному міститься 25 мг йоду, який входить в склад різних сполук, причому 70 % маси йоду знаходиться в щитовидній залозі:
1) В щитовидній залозі міститься атомів йоду:
а) 8,3 ∙1019; б) 5,5 ∙ 1023;
в) 6,02 ∙ 1023; г) 1,18 ∙ 1020.
2) В цілому в організмі міститься атомів йоду:
а) 1,19 ∙1021; б) 5,5 ∙ 1023;
в) 6,02 ∙ 1023; г) 1,19 ∙ 1020.
3) Недостаток йоду в організмі людини викликає хворобу:
а) зоб; б) токсикоз;
в) антраказ; г) авітаміноз.
4) У якій масі КІ міститься 25мг йоду?
а) 33 мг; б) 53 мг; в) 0,53 г; г) 15 мг.
5) Яку масу йоду треба взяти для приготування 150 г спиртового розчину, який використовується для дезинфекції у вигляді 5 % розчину?
а) 5,5 г; б) 12,5 г; в) 7,5 г; г) 1,25 г.
3.4. У шлунковому соці міститься соляна кислота, яка практично повністю дисоціює у водних розчинах:
1) Розрахуйте молярну концентрацію HCl, якщо масова частка її в розчині 0,05 % (ρ=1г/см3)
а) 0,0137 моль/г; б) 0,0274 моль/г;
в) 0,148 моль/г; г) 0,303 моль/г.
2) Розрахуйте рН даного шлункового соку:
а) 2,66; б) 0,86; в) 1,86; г) 1,56.
3) рН шлункового соку в нормі:
а) 2,0-4,0; б) 4,0-6,0;
в) 0,9-2,0; г) 0,5-1,0.
4) Досліджуваний шлунковий сік є:
а) в нормі;
б) має підвищену кислотність;
в) має понижені кислотність;
г) має нульову кислотність.
5) Який об’єм розчину NaOH з См=0,01 моль/л треба затратити на нейтралізацію 2,0 мл даного шлункового соку:
а) 1,37 мл; б) 0,28 мл;
в) 0,147мл; г) 2,74 мл.
4.5. Питна сода (NaHCO3) використовується для полоскання горла у вигляді 2 %-го розчину.
1) Розрахуйте, скільки грамів соди треба розчинити в стакані води (200 мл), що отримати 2 %-ний розчин:
а) 1 г; б) 2 г; в) 4,1г; г) 5 г.
2) Яка молярна концентрація одержаного розчину (ρ=1,02 г/мл):
а) 0,125 моль/л; б) 0,25 моль/л;
в) 0,303 моль/л; г) 0,05 моль/л.
3) Виберіть формулу для розрахунку осмотичного тису даного розчину:
а)  ; б) π=іСRТ;
; б) π=іСRТ;
в) π=СRT г) 
4) Який осмотичний тиск створює даний розчин:
а) 740 кПа; б) 780 кПа;
в) 1288,7 кПа; г) 2088 кПа.
5) Дайте характеристику одержаного розчину:
а) ізотонічний; б) гіпотонічний;
в) гіпертонічний; г) фізіологічний.
4.6. При дослідженні якості питної води одним із показників є її твердість
1) Твердість води обумовлена присутністю у воді розчинених солей. Які із наведених сполук обумовлюють тимчасову твердість води?
а) Са(НСО3)2; Мg(HCO3)2;
б) СаCl2, MgCl2., CaSO4 , MgSO4;
в) СаСО3 ; МgCO3 MgSO4, CaSO4;
г) Мg(НCO3)2, СаCl2, MgSO4, CaSO4.
2) Для визначення тимчасової твердості води використовують реакцію нейтралізації 50 мл досліджуваної води в присутності метилоранжу робочим розчином НСl (СЕ=0,1 моль-екв/ л) До досягнення точки еквівалентності витратилося 2,2 мл розчину НСl. Розрахувати тимчасову твердість води:
а) Ттимч. =3,2 ммоль –екв/ л;
б) Ттимч. =4,4 ммоль –екв/ л;
в) Ттимч. =5,8 ммоль –екв/ л;
г) Ттимч. =3,0 ммоль –екв/ л;
3) Загальну твердість води визначають комплексонометрично. На титрування 5 мл досліджуваної води в присутності амонійного буферу і хромогену темно синього до досягнення точки еквівалентності витратилося 4,3 мл стандартного розчину трилону Б (СЕ=0,01 моль-екв/ л)Яка загальна твердість води?
а) Т заг. =10,4 ммоль-екв/л;
б) Т заг. =13,0 ммоль-екв/л;
в) Т заг. =14,4 ммоль-екв/л;
г) Т заг. =8,6 ммоль-екв/л.
4) Досліджувана вода має постійну твердість:
а) Тпост =7,4 ммоль-екв/ л;
б) Тпост =8,6 ммоль-екв/ л;
в) Тпост =4,2 ммоль-екв/ л;
г) Тпост =9,4 ммоль-екв/ л.
5) На основі проведених досліджень і за шкалою твердості досліджувана вода є:
а) м’ якою, непридатною для пиття;
б) твердою, придатною для пиття;
в) середньої твердості, придатною для пиття;
г) дуже твердою, непридатною для пиття.
4.7. При наданні допомоги в умовах надзвичайної ситуації в лікарні закінчився фізіологічний розчин. Для одержання фізіологічного розчину було вирішено приготувати його.
1) Які із наявних речовин можна використати для одержання фізіологічного розчину:
а) кухонна сіль; б) цукор;
в) хлорид магнію; г) сульфат кальцію;
2) Для розрахунку концентрації речовини, з якої можна отримати розчин можна використати формулу:
а)  ; б)
; б) 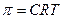 ;
;
в) 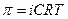 ; г)
; г) 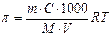 .
.
3) Розрахувати молярну і масову концентрацію вихідної речовини, які потрібно взяти для приготування 1 л розчину:
а) 0,303; 4,5%; б) 0,146; 0,9%;
в) 0,300; 0,9%; г) 0,140; 4,5%
4) Скільки грам вихідної речовини необхідної взяти для того, щоб одержати 5 літрів фізіологічного розчину (ρ=1,0024 г/см3)
а) 90,09 г; б) 42,71г;
в) 112,45г; г) 22,55г.
5) Який процес буде відбуватись при введенні в кров одержаного розчину:
а) гемоліз; б) буде проходити екзосмос;
в) плазмоліз; г) не буде проходити осмос.
4.8. При виконанні науково-дослідної роботи необхідно приготовити буферний розчин, який відповідає значенню рН=6,8.
1) Які з наведених буферних сумішей підходять для приготування такого розчину?
а) Na2HPO4 і NaH2PO4;
б) NH4OH і NH4Cl;
в) Н2СО3 і NаHСО3;
г) СН3СООН і СН3СООNa.
2) Розрахувати об’єми розчинів, які необхідні для приготування 100 мл буферної системи з рН=6,8, якщо молярні концентрації еквівалентів вихідних розчинів 0,1 моль/л (К=6,2∙10-8)
а) V1= 25 мл V2=75 мл;
б) V1= 28 мл V2=72 мл;
в) V1= 30 мл V2=70 мл
г) V1= 35 мл V2=65 мл.
3) Визначити, як зміниться рН даного буферного розчину, (рН=6,8), якщо до нього додати 10 мл кислоти з молярною концентрацією еквівалентів 0,1 моль/л.
а) рН = 6,99 б) рН = 7,1;
в) рН = 6,8; г) рН = 4,5.
4) Фосфатна буферна система представлена рівнянням.
а) NaH2PO4+ Na2HPO4;
б) Na3PO4+ K3PO4;
в) K2HPO4+ Na2HPO4
г) H3PO4+ Na2HPO4.
5) Механізм дії буферних систем направлений на:
а) нейтралізацію кислих і лужних продуктів;
б) відновлення кислих і лужних продуктів;
в) гідроліз кислих і лужних продуктів;
г) окиснення кислих і лужних речовин.
4.9. Для дослідження кислотно-основного стану крові у пацієнта було взято для аналізу 5 мл крові з якою були проведені аналізи.
1) На визначення буферної ємності даної крові за кислотою провели титрування 2 мл крові розчином HCl з С=0,01 моль/л і на зміну рН від 7,36 до 6,9 було витрачено 1,5 мл розчину HCl. Розрахована буферна ємність:
а) ВК = 0,016; б) ВК = 0,25;
в) ВК = 0,0015; г) ВК = 0,15.
2) На визначення буферної ємності даної крові за основою провели титрування 2 мл крові розчином NaOH з С=0,02 моль/л і на зміну рН від 7,36 до 8,4 було витрачено 3,5 мл розчину NaOH. Розрахована буферна ємність.
а) ВО = 0,035; б) ВО =0,064;
в) ВО =0,033; г) ВО =0,040.
3) Визначити скільки мл розчину HCl з С=0,02 моль/л треба додати до 50 мл крові, щоб змінити її рН з 7,36 до 7,1 якщо ВК = 0,05.
а) VK = 35 мл; б) VK = 29,5 мл;
в) VK = 34,5 мл; г) VK = 32,5 мл.
4) Кислотно-основна рівновага крові визначається:
а) величиною рН, концентрацією йонів НСО3-, тиском СО2 в крові;
б) величиною рН, концентрацією йонів ОН-, тиском СО2 в крові;
в) величиною рН, температурою, концентрацією йонів ОН-;
г) концентрацією йонів Н3О; ОН-, температурою.
5) Які буферні системи забезпечують буферну ємність людського організму.
а) гемоглобінові, фосфатна, гідрокарбонатна, білкова;
б) гемоглобінові, фосфатна, гідрокарбонатна, ацетатна;
в) гемоглобінові, фосфатна, амонійна, білкова;
г) гемоглобінові, ацетатна, амонійна, білкова.
4.10. В хірургічній практиці використовують розчини, які сприяють виведенню із гнійних ран продуктів розкладу.
1) Для цього необхідно використати розчин:
а) ізотонічний; б) гіпертонічний;
в) гіпотонічний; г) фізіологічний.
2) Які з наявних в лікарні розчинів найкраще використати для цього:
а) 5%-ний р-н глюкози;
в) 0,5%-ний р-н NaCl;
б) 0,9%-ний р-н NaCl;
г) 10%-ний р-нMgSO4
3) Розрахувати масу солі необхідної для приготування 200мл такого розчину (ρ = 1,12 г/мл)
а) 20 г; б) 22.4 г; в) 5 г; г) 2.1.
4) Молярна концентрація цього розчину:
а) 0,14; б) 0,07; в) 0,42; г) 0,93.
5) Розрахувати осмотичний тиск одержаного розчину і вказати які процеси будуть проходити при введенні його в кров:
а) гемолізу; 537 кПа;
б) плазмолізу; 4794 кПа;
в) ендоосмос; 800 кПа
г) екзосмосу 1047 кПа.
4.11. При дослідженні якості питної води одним із показників є її твердість
1) Твердість води обумовлена присутністю у воді розчинених солей. Які із наведених сполук обумовлюють постійну твердість води?
а) Са(НСО3)2; Мg(HCO3)2;
б) СаCl2, MgCl2., CaSO4 , MgSO4;
в) СаСО3 ; МgCO3 MgSO4, CaSO4;
г) Мg(НCO3)2, СаCl2, MgSO4, CaSO4.
2) Для визначення тимчасової твердості води використовують реакцію нейтралізації 50 мл досліджуваної води в присутності метилоранжу робочим розчином НСl (СЕ=0,1 моль-екв/ л) До досягнення точки еквівалентності витратилося 1,2 мл розчину НСl. Розрахувати тимчасову твердість води:
а) Ттимч. =3,2 ммоль –екв/ л;
б) Ттимч. =2,4 ммоль –екв/ л;
в) Ттимч. =5,8 ммоль –екв/ л;
г) Ттимч. =3,0 ммоль –екв/ л;
3) Загальну твердість води визначають комплексонометрично. На титрування 5 мл досліджуваної води в присутності амонійного буферу і хромогену темно синього до досягнення точки еквівалентності витратилося 3,8 мл стандартного розчину трилону Б (СЕ=0,01 моль-екв/ л)Яка загальна твердість води?
а) Т заг. =10,4 ммоль-екв/л;
б) Т заг. =8,0 ммоль-екв/л;
в) Т заг. =7,6 ммоль-екв/л;
г) Т заг. =12,4 ммоль-екв/л.
4) Досліджувана вода має постійну твердість:
а) Тпост =7,4 ммоль-екв/ л;
б) Тпост =3,6 ммоль-екв/ л;
в) Тпост =8,6 ммоль-екв/ л;
г) Тпост =5,2 ммоль-екв/ л.
5) На основі проведених досліджень і за шкалою твердості досліджувана вода є:
а) м’ якою, непридатною для пиття;
б) твердою, придатною для пиття;
в) середньої твердості, придатною для пиття;
г) дуже твердою, непридатною для пиття.
4.12. При клінічному дослідженні шлункового соку визначено його рН= 1,65. Розрахувати:
1)Яка концентрація йонів водню в цій пробі шлункового соку?
а) 1,12 ∙ 10-4; б) 2,24 ∙ 10-2;
в) 2,12 ∙ 10-3; г) 1,84 ∙ 10-2.
2) Яка концентрація гідроксид-йонів в цьому соці?
а) [ОН-] = 2,23∙10-2; б) [ОН-] = 2,87∙10-8;
в) [ОН-] = 4,46∙10-13; г) 1,13∙10-13.
3) У скільки разів необхідно зменшити концентрацію йонів водню, щоб збільшити величину рН даного соку на одиницю?
а) у 5 разів; б) у 10 разів;
в) у 7 разів; г) у 3 рази.
4) Як зміниться величина рН даного шлункового соку коли до 10 мл його додати 10 мл розчину NaOH з концентрацією С=0,01 моль/ л?
а) збільшиться; б)зменшиться;
в) не зміниться; г) різко зменшиться.
5) Як зміниться величина рН даного шлункового соку, коли до 10 мл його додати 10 мл розчину HCl з концентрацією С=0,02 моль/л?
а) збільшиться; б) не зміниться;
в) зменшиться; г) різко зросте.
4.13. При анеміях як внутрішній засіб використовують 8,3 %-ий розчин HCl (ρ = 1,04) На один прийом беруть 0,75 мл цього розчину і розводять водою до 50 мл. Розрахувати:
1) Яка масова концентрація одержаного розчину кислоти (ρ=1г/см3):
а) 0,02%; б) 0,13 в) 0,14%; г) 0,15%.
2) Яка молярна концентрація одержаного розчину кислоти:
а) 0,005 моль/л; б) 0,015 моль/л;
в) 0,025 моль/л; г) 0,035 моль/л.
3) Яка концентрація йонів водню в одержаному розчині кислоти?
а) [Н+]=5 ∙ 10-3; б) [Н+]=1,5 ∙ 10-2;
в) [Н+]=3,5 ∙ 10-2; г) [Н+]=2,5 ∙ 10-2.
4)Яке значення рН одержаного розчину кислоти?
а) рН=1,46; б) рН=1,36;
в) рН=1,26; г) рН=1,16.
5) Недостача якого мікроелемента в організмі зумовлює розвиток анемії?
а) Fe; б) Br; в) Se; г) Cd.
4.14. При виконанні науково-дослідної роботи необхідно приготовити буферний розчин, який відповідає значенню рН=4,65.
1) Які із наведених буферних сумішей підходить для приготування такого розчину?
а) H2CO2 + NaHCO3;
б) CH3COOH + CH3COONa;
в) NH4OH + NH4Cl;
г) Na2HPO2 + NaH2PO4.
2) Розрахувати об’єми розчинів, які необхідні для приготування 100 мл буферної системи з рН=4,65, якщо молярні концентрації еквівалентів вихідних розчинів 0,1 моль/л. (К=1,8*10-5)
а) VК=48 мл VС=52 мл;
б) VК=35 мл VС=65 мл;
в) VК=55 мл VС=45 мл;
г) VК= 40 мл VС=60 мл
3) Визначити, як зміниться рН даного буферного розчину (рН=4,65), якщо до нього додати 10 мл кислоти з молярною концентрацією еквівалентів 0,1 моль/л. (К=1,8*10-5)
а) рН=4,48; б) рН=5,01;
в) рН=3,8; г) рН=9.1.
4) Гідрокарбонатна буферна система представлена рівнянням:
а) H2CO3 + NaCl; б) H2CO3 + Na2CO3;
в) H2CO3 + NaHCO3; г) HCl + NaOH.
5) Яку із наведених речовин можна використовувати для коригування кислотно-основного стану організму при ацидозі:
а) NaHCO3; б) NaCl
в) HCl г) аскорбінову кислоту.
4.15. Для дослідження кислотно-основного стану крові у пацієнта було взято для аналізу 10 мл крові, з якою були проведені аналізи.
1) На визначення буферної ємності даної крові за кислотою провели титрування 5 мл крові розчином HCl з С=0,02 моль/л. на зміну рН від 7,36 до 6,9 було витрачено 2 мл розчину HCl. Розрахувана буферна ємність.
а) ВК = 0,021; б) ВК = 0,017;
в) ВК = 0,17; г) ВК = 0,019.
2) На визначення буферної ємкості даної крові за основою провели титрування 5 мл крові розчином NaOH з С=0,01 моль/л. на зміну рН від 7,36 до 8,4 було витрачено 4.5 мл розчину NaOH. Розрахувана буферна ємність.
а) ВО = 0,0086; б) ВО = 0,086;
в) ВО = 0,0079; г) ВО = 0,050.
3). Визначити скільки мл розчину HCl з С = 0,01 моль/л треба додати до 20 мл крові, щоб змінити її рН з 7,36 до 7,1, якщо В=0,02.
а) VК = 8 мл; б) VК = 5,5 мл;
в) VК = 12 мл; г) VК = 10.4 мл.
4) Значення рН плазми крові в нормі може знаходитись:
а) 7,35-7,45; б) 6,80-7,0;
в) 7,15-7,35; г) 8,01-8,35.
5) Які буферні системи забезпечують буферну ємність людського організму.
а) гідрокарбонатна, фосфатна, амонійна, ацетатна;
б) гідрокарбонатна, фосфатна, білкова, амонійна;
в) гідрокарбонатна, білкова, ацетатна, фосфатна;
г) гідрокарбонатна, білкова, фосфатна, гемоглобінова.
4.16. При клінічному дослідженні шлункового соку визначено його рН= 1,85. Розрахувати:
1) Дане значення рН відповідає кислотності шлункового соку:
а) в нормі; б) підвищеній;
в) пониженій; г) ацидозу.
2)Яка концентрація йонів водню в цьому шлунковому соці?
а) 2,24 ∙ 10-2; б) 1,41 ∙ 10-2;
в) 2,12 ∙ 10-3; г) 1,84 ∙ 10-2.
3) Яка формула використовується для розрахунку рН розбавленого розчину HCl?
а) рН = -ℓg[Н+]; б) рН = 14 – рОН;
в) рН = - ℓgСОН- г) рН = -ℓg[Н+]∙2
4) Як зміниться величина рН даного шлункового соку коли до 10 мл його додати 10 мл розчину NaOH з концентрацією С=0,01 моль/ л?
а) збільшиться; б)зменшиться;
в) не зміниться; г) різко зменшиться.
5) Яку із наведених речовин можна використовувати для коригування кислотно-основного стану організму при ацидозі:
а) NaHCO3; б) NaCl
в) HCl г) аскорбінову кислоту.
4.17. При анеміях як внутрішній засіб використовують 8,3 %-ий розчин HCl (ρ=1,04г/см3) На один прийом беруть 0,75 мл цього розчину і розводять водою до 50 мл. Розрахувати:
1) Яка маса чистої HCl в отриманому розчині:
а) 0,130; б) 0,090; в) 0,065 ; г) 0,150.
2) Яка масова концентрація одержаного розчину кислоти (ρ=1 г/см3):
а) 0,122%; б) 0,15%; в) 0,22%; г) 0,35%.
3) Яка молярна концентрація одержаного розчину кислоти:
а) 0,0212; б) 0,0335; в) 0,0258; г) 0,0035.
4) Чому дорівнює молярна маса еквівалента хлоридної кислоти у реакції з кальцій гідроксидом:
а) 36,5 г/моль; б) 18,25 г/моль;
в) 36 г; г) 73 г/моль.
5) Розчин AgNO3 є якісним реагентом на:
а) Cl; б) Ba; в) SO42-; г) Fe3+.
4.18. Необхідно приготувати ізотонічний розчин із наявних в лабораторії речовин.
1) Виберіть, яка із речовин може бути використана для виготовлення ізотонічного розчину:
а) калію хлорид; б) глюкоза;
в) магнію сульфат; д) етанол.
2) Виберіть формулу для розрахунку концентрації ізотонічного розчину.
а)  ; б) π=іСR;
; б) π=іСR;
в) π=СRT г) 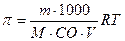
3) Осмотичний тиск крові людини в нормі:
а) 800кПа; б) 730 кПа;
в) 790 кПа; г) 750 кПа.
4) Розрахуйте молярну концентрацію ізотонічного розчину, виготовленого із вибраної речовини:
а) 0,291 моль/л; б) 0,150 моль/л;
в) 0,200 моль/л; г) 0,403 моль/л.
5) Розрахувати масу вибраної речовини необхідної для приготування 600 мл ізотонічного розчину.
а) 15,54 г; б) 32,72 г; в) 62,17 г; г) 21,5 г.
4.17. Для полоскання горла використовують розчин соди(NaHCO3) 1 чайна ложка (5 г) на стакан води (200г)
1) Концентрація одержаного розчину:
а)2,44%; б)5,2%; в) 2,5%; г) 1,5%.
2) Одержаний розчин створює осмотичний тиск, який можна розрахувати за формулою:
а) 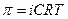 ; б)
; б) 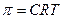 ;
;
в)  ; г)
; г)  .
.
3)Яка молярна концентрація одержаного розчину (ρ = 1,05 г/мл):
а) 0,48 моль/л; б) 0,313 моль/л;
в) 0,205 моль/л; г) 0,410 моль/л.
4) Одержаний розчин в органінізмі створює осмотичний тиск:
а) 2730,5 кПа; б) 748,65 кПа;
в) 2994,62 кПа; г) 1614,8 кПа.
5) Цей розчин є:
а) ізотонічний; б) гіпертонічний;
в) гіпотонічний; г) фізіологічний.
4.19. При виконанні науково-дослідної роботи необхідно приготовити буферний розчин, який відповідає значенню рН=6,8.
1) Які з наведених буферних сумішей підходять для приготування такого розчину?
а) Na2HPO4 і NaH2PO4;
б) NH4OH і NH4Cl;
в) Н2СО3 і NaHCO3;
г) СН3СООН і СН3СООNa.
2) Розрахувати об’єми розчинів, які необхідні для приготування 100 мл буферної системи з рН=6,8, якщо молярні концентрації еквівалентів вихідних розчинів 0,1 моль/л (К=6,2∙10-8)
а) V1= 28 мл V2=72 мл
б) V1= 25 мл V2=75 мл
в) V1= 30 мл V2=70 мл
г) V1= 35 мл V2=65 мл
3) Визначити, як зміниться рН даного буферного розчину, (рН=6,8), якщо до нього додати 10 мл кислоти з молярною концентрацією еквівалентів 0,1 моль/л.
а) рН = 6,8; б) рН = 7,1;
в) рН = 6,55 г) рН = 4,5.
4) Одержаний буферний розчин можна віднести до буферів:
а) кислотних; б) основних;
в) нейтральних; г) амфотерних.
5) Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти чи лугу:
а) електролітична дисоціація, протоліз, нейтралізація;
б) електролітична дисоціація, протоліз, гідроліз;
в) гідроліз, протоліз, нейтралізація;
г) окислення, гідроліз, протоліз.
4.20. При наданні допомоги в умовах надзвичайної ситуації в лікарні закінчився фізіологічний розчин. Для одержання фізіологічного розчину було вирішено приготувати його.
1) Які із наявних речовин можна використати для одержання фізіологічного розчину:
а) кухонна сіль; б) цукор;
в) хлорид магнію; г) сульфат кальцію.
2) Осмотичний тиск крові людини:
а)800-850 кПа; б) 720-740 кПа;
в) 740-780 кПа; г) 350-400 кПа.
3) Для розрахунку концентрації речовини, з якої можна отримати розчин можна використати формулу:
а) 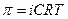 б)
б) 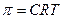
в)  г)
г) 
4) Розрахувати молярну концентрацію вихідної речовини:
а) 0,300; б) 0,303; в) 0,148; г) 0,140.
5) Скільки грам вихідної речовини необхідної взяти для того, щоб одержати 5 літрів фізіологічного розчину.
а) 45,10 г; б) 43,29;
в) 90,5 г; г) 112,72 г.
4.21. Для дослідження кислотно-основного стану крові у пацієнта було взято пробу 5 мл крові, з якою були проведені аналізи.
1) На визначення буферної ємності даної крові за кислотою провели титрування 2 мл крові розчином HCl з С=0,01 моль/л і на зміну рН від 7,36 до 6,9 було витрачено 1,5 мл розчину HCl. Розрахувати буферну ємність.
а) ВК = 0,016; б) ВК = 0,25;
в) ВК = 0,0015; г) ВК = 0,15.
2) На визначення буферної ємності даної крові за основою провели титрування 2 мл крові розчином NaOH з С=0,02 моль/л і на зміну рН від 7,36 до 8,4 було витрачено 3,5 мл розчину NaOH. Розрахувати буферну ємність.
а) ВО = 0,035; б) ВО =0,067;
в) ВО =0,033; г) ВО =0,040.
3) Визначити скільки мл розчину NaOH з С=0,01 моль/л треба додати до 20 мл крові, щоб змінити її рН від 7,45 до 8,4 , якщо В0=0,01.
а) Vo = 10 мл; б) Vo =19 мл;
в) Vo = 8,5 мл; г) Vo = 11 мл.
4) Механізм дії на гідрокарбонатну буферну системукислотою представлений в рівнянні:
а) Нb- + H3O+↔HHb + H2O;
б) H3O+ + OH- ↔ 2H2O;
в) HPO4-2 + H3O+ ↔ H2PO4- + H2O;
г) H3O+ + HCO3- ↔ H2CO3 + H2O.
5) Які буферні системи забезпечують гомеостаз людського організму.
а) гемоглобінові, фосфатна, гідрокарбонатна, білкова;
б) гемоглобінові, фосфатна, гідрокарбонатна, ацетатна;
в) гемоглобінові, фосфатна, амонійна, білкова;
г) гемоглобінові, ацетатна, амонійна, білкова.
4.22. При дослідженні якості питної води одним із показників є її твердість
1) Твердість води обумовлена присутністю у воді розчинених солей. Які із наведених сполук обумовлюють тимчасову твердість води?
а) Са(НСО3)2; Мg(HCO3)2;
б) СаCl2, MgCl2., CaSO4 , MgSO4;
в) СаСО3 ; МgCO3 MgSO4, CaSO4;
г) Мg(НCO3)2, СаCl2, MgSO4, CaSO4.
2) Для визначення тимчасової твердості води використовують реакцію нейтралізації 50 мл досліджуваної води в присутності метилоранжу робочим розчином НСl (СЕ=0,1 моль-екв/ л) До досягнення точки еквівалентності витратилося 2,2 мл розчину НСl. Тимчасова твердість води:
а) Ттимч. =3,0 ммоль –екв/ л;
б) Ттимч. =4,4 ммоль –екв/ л;
в) Ттимч. =5,8 ммоль –екв/ л;
г) Ттимч. =3,0 ммоль –екв/ л;
3) Загальну твердість води визначають комплексонометрично. На титрування 5 мл досліджуваної води в присутності амонійного буферу і хромогену темно синього до досягнення точки еквівалентності витратилося 4,3 мл стандартного розчину трилону Б (СЕ=0,01 моль-екв/ л)Яка загальна твердість води?
а) Т заг. =10,4 ммоль-екв/л;
б) Т заг. =13,0 ммоль-екв/л;
в) Т заг. =8,6 ммоль-екв/л;
г) Т заг. =12,4 ммоль-екв/л.
4) Досліджувана вода має постійну твердість:
а) Тпост =7,4 ммоль-екв/ л;
б) Тпост =8,6 ммоль-екв/ л;
в) Тпост =4,2 ммоль-екв/ л;
г) Тпост =9,4 ммоль-екв/ л.
5) На основі проведених досліджень і за шкалою твердості досліджувана вода є:
а) м’ якою, непридатною для пиття;
б) твердою, придатною для пиття;
в) середньої твердості, придатною для пиття;
г) дуже твердою, непридатною для пиття.
4.23. В хірургічній практиці використовують розчини, які сприяють виведенню із гнійних ран продуктів розкладу.
1) Для цього необхідно використати розчин:
а) ізотонічний; б) гіпертонічний;
в) гіпотонічний; г) фізіологічний.
2) Який з наявних в лікарні розчинів найкраще використати для цього:
а) 0,9%-ний р-н NaCl;
б) 10%-ний р-нMgSO4;
в) 5%-ний р-н глюкози;
г) 5%-ний р-н NaCl
3) Розрахувати масу солі необхідної для приготування 200мл такого розчину (ρ = 1,12 г/мл)
а) 10,5 г; б) 33,4 г; в) 11,2 г; г) 22,4 г.
4) Молярна концентрація цього розчину:
а) 0,09 моль/л; б) 0,96 моль/л;
в) 0,05 моль/л; г) 0,5 моль/л.
5) Розрахуйте осмотичний тиск одержаного розчину та вкажіть, який процес буде проходити при введенні цього розчину в кров:
а) 1680 кПа гемолізу; б) 780 кПадифузії;
в)3878 кПа плазмолізу; г) 1350 кПа гемолізу.
4.24. При клінічному дослідженні шлункового соку визначено його рН= 1,65. Розрахувати:
1)Яка концентрація йонів водню в шлунковому соці?
а) 2,24 ∙ 10-2; б) 1,12 ∙ 10-4;
в) 2,12 ∙ 10-3; г) 1,84 ∙ 10-2.
2) Яка концентрація гідроксид-йонів в цьому соці?
а) 2,23∙10-6; б) 2,87∙10-8;
в) 4,47∙10-13; г) 1,13∙10-8.
3) У скільки разів необхідно зменшити концентрацію йонів водню, щоб збільшити величину рН даного соку на одиницю?
а) у 5 разів; б) у 10 разів;
в) у 7 разів; г) у 3 рази.
4) Як зміниться величина рН даного шлункового соку коли до 10 мл його додати 10 мл розчину NaOH з концентрацією С=0,01 моль/ л?
а) збільшиться; б)зменшиться;
в) не зміниться; г) різко зменшиться.
5) Чи зміниться величина рН даного шлункового соку, коли до 10 мл його додати 10 мл розчину HCl з концентрацією С=0,02 моль/л?
а) збільшиться; б) не зміниться;
в) зменшиться; г) різко зросте.
– Конец работы –
Эта тема принадлежит разделу:
З медичної хімії Комплексоутворення в біологічних системах
з медичної хімії Комплексоутворення в біологічних системах... для студентів спеціальностей Лікувальна справа та Педіатрія... Рівень...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: СИТУАЦІЙНІ ЗАДАЧІ
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов