рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Информатика
- /
- Термохимия. Элементы химической термодинамики. Химическое равновесие
Реферат Курсовая Конспект
Термохимия. Элементы химической термодинамики. Химическое равновесие
Термохимия. Элементы химической термодинамики. Химическое равновесие - раздел Информатика, Информационно-вычислительных технологий в химии 1. Что Является Предметом Изучения Термохимии И Термодинамики? Что Позволяет ...
1. Что является предметом изучения термохимии и термодинамики? Что позволяет предсказывать химическая термодинамика в отношении химических реакций?
2. Охарактеризуйте различие между изолированными, закрытыми и открытыми системами. Приведите примеры для каждого из перечисленных типов систем.
3. Как взаимосвязаны между собой такие понятия, как «термодинамическая система», «термодинамические параметры» и «термодинамические свойства»? Каково различие между интенсивными и экстенсивными свойствами? Приведите примеры тех и других.
4. Каковы признаки процесса в термодинамической системе? Какая классификация процессов существует в зависимости от параметров, которые в ходе процессов остаются постоянными или становятся переменными?
5. Что показывает тепловой эффект химической реакции? Как определяют знак теплового эффекта, например, экзотермической реакции, на основе термодинамической и термохимической систем знаков?
6. Дайте определение энтальпии. Докажите, что энтальпия есть функция состояния системы. Является ли энтальпия экстенсивным или интенсивным параметром? В каких условиях приближенно соблюдается равенство ΔН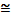 ΔU?
ΔU?
7. Опишите конструкцию калориметра – прибора для измерения тепловых эффектов химических реакций. Как производится в нём измерение теплового эффекта реакции? Что означает понятие «теплоёмкость калориметра» и как её значение используют при вычислении теплового эффекта реакции?
8. Дайте определение стандартной энтальпии образования химического соединения ΔНºf.Какие вещества приняты в качестве простых? Какие значения ΔНºfустановленыдля простых веществ?
9. Как формулируется закон Гесса? Как можно объяснить справедливость этого закона, если исходить из того, что энтальпия есть функция состояния системы? Почему энтальпия реакции зависит от фазового состояния веществ – участников реакции?
10. Если известны значения энтальпий образования всех веществ – участников реакции, то можно вычислить энтальпии в результате реакции (энтальпию реакции). Каков порядок вычисления ΔН º реакции? Какую роль при вычислении этой величины играют стехиометрические коэффициенты в уравнении реакции? Как изменится величина ΔН º реакции, если все стехиометрические коэффициенты в её уравнении умножить (или разделить) на одно и то же число? Каковы единицы СИ ΔН ºреакции?
11. Энтальпия является функцией состояния системы. Почему с помощью энтальпии невозможно однозначно описать переход системы из одного состояния в другое? Какие функции состояния системы используются наряду с энтальпией для описания химических превращений?
12. Дайте определение энтропии. В каких системах энтропия может однозначно определять направление процессов и какова формулировка второго закона термодинамики для данного типа систем? Почему стандартные энтальпии образования веществ задают в форме изменения энтальпии ΔНºf, а стандартные энтропии веществ – в форме абсолютных значений энтропии S˚? Какова роль третьего закона термодинамики в определении абсолютных значений энтропии веществ? Приведите единицы СИ энтропии. Как вычисляют изменение энтропии ΔS˚в результате реакции?
13. Приведите уравнения, являющиеся основой для определения энергии Гельмгольца и энергии Гиббса? Для каких типов процессов используется каждая из этих функций состояния системы? Для каких систем и процессов удобно использовать энергию Гиббса? Как величина ΔGопределяет направление самопроизвольных процессов и состояние равновесия?
14. Используя уравнение ΔG˚=ΔНº- TΔS˚для качественной оценки направления самопроизвольного протекания химической реакции, принято выделять и сопоставлять роль «энтальпийного фактора» (ΔН) и «энтропийного фактора» (–TΔS). Покажите, как учёт этих факторов позволяет предсказать направлении реакции при различных температурах: низких и достаточно высоких.
15. Как можно использовать справочные значения ΔНºf, S˚, ΔG˚f для оценки устойчивости веществ? Могут ли существовать при стандартных условиях химические соединения, для которых энергия Гиббса является величиной положительной (ΔG˚f> 0). Как можно оценить относительную устойчивость веществ одного класса.
16. Какое состояние называется химическим равновесием? Происходит ли в состоянии химического равновесия соударение и взаимодействие частиц исходных веществ и продуктов реакции? Что происходит с концентрациями исходных веществ и продуктов реакции, когда наступает состояние химического равновесия?
17. Как составляют математическое выражение константы химического равновесия? Какие особенности гетерогенных систем нужно учитывать при составлении выражения константы химического равновесия?
18. Сформулируйте правило Ле Шателье. Примените данное правило для объяснения направления сдвига химического равновесия конкретных химических реакций, раздельно покажите влияние на равновесие таких факторов, как концентрация исходных веществ или продуктов, давление в случае газообразных участников реакции, температура. Какова роль катализаторов при достижении системами состояния химического равновесия?
– Конец работы –
Эта тема принадлежит разделу:
Информационно-вычислительных технологий в химии
Федеральное государственное бюджетное образовательное учреждение... высшего профессионального образования...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Термохимия. Элементы химической термодинамики. Химическое равновесие
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов