Постоянная Планка
Свет представляет собой форму лучистой энергии, которая распространяется в пространстве в виде электромагнитных волн. В 1900 году ученый Макс Планк – один из основоположников квантовой механики – предложил теорию, согласно которой лучистая энергия испускается и поглощается не непрерывным волновым потоком, а отдельными порциями, которые получили название квантов (фотонов).
Энергия, переносимая одним квантом, равна: E = hv, где v – частота излучения, а h – элементарный квант действия, представляющий собой новую универсальную константу, получившую вскоре название постоянная Планка (по современным данным h = 6,626 × 10–34 Дж·с).
В 1913 году Нильс Бор создал стройную, хотя и упрощенную модель атома, согласующуюся с распределением Планка. Бор предложил теорию излучения, в основу которой положил следующие постулаты:
1. В атоме существуют стационарные состояния, находясь в котором атом не излучает энергию. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны;
2. При переходе электрона с одной стационарной орбиты на другую (из одного стационарного состояния в другое) излучается или поглощается квант энергии hν = |Ei – En| , где ν – частота излучаемого кванта, Ei – энергия состояния, из которого переходит, а En – энергия состояния, в которое переходит электрон.
Если электрон под каким-либо воздействием переходит с орбиты, близкой к ядру на какую либо другую более удаленную, то энергия атома увеличивается, но что требуется затрата внешней энергии. Но такое возбужденное состояние атома малоустойчиво и электрон падает обратно по направлению к ядру на более близкую возможную орбиту.
А когда электрон перескакивает (падает) на орбиту, лежащую ближе к ядру атома, то потерянная атомом энергия переходит в один квант лучистой энергии, испускаемой атомом.
Соответственно, любой атом может излучать широкий спектр связанных между собой дискретных частот, который зависит от орбит электронов в составе атома.
Атом водорода состоит из протона и движущегося вокруг него электрона. Если электрон поглощает порцию энергии, то атом переходит в возбужденное состояние. Если же электрон отдает энергию, то атом переходит из более высокого в менее высокое энергетическое состояние. Обычно переходы из более высокого энергетического состояния в менее высокое сопровождаются излучением энергии в форме света. Однако, возможны также и безызлучательные переходы. В этом случае атом переходит в менее высокое энергетическое состояние без излучения света, а избыток энергии отдает, например, другому атому при их столкновении.
Если атом, переходя из одного энергетического состояния в другое, излучает спектральную линию с длиной волны λ, то, в соответствии со вторым постулатом Бора, излучается энергия Е равная:  , где h - постоянная Планка; c - скорость света.
, где h - постоянная Планка; c - скорость света.
Совокупность всех спектральных линий, которые может излучать атом, называется его спектром испускания.
Как показывает квантовая механика, спектр атома водорода выражается формулой:
 , где R – постоянная, называемая постоянной Ридберга; n1 и n2 числа, причем n1 < n2.
, где R – постоянная, называемая постоянной Ридберга; n1 и n2 числа, причем n1 < n2.
Каждая спектральная линия характеризуется парой квантовых чисел n2 и n1. Они указывают энергетические уровни атома соответственно до и после излучения.
При переходе электронов с возбужденных энергетических уровней на первый (n1 = 1; соответственно n2 = 2, 3, 4, 5…) образуется серия Лаймана. Все линии серии Лаймана находятся в ультрафиолетовом диапазоне.
Переходы электронов с возбужденных энергетических уровней на второй уровень (n1 = 2; соответственно n2 = 3,4,5,6,7…) образуют серию Бальмера. Первые четыре линии (то есть при n2 = 3, 4, 5, 6) находятся в видимом спектре, остальные (то есть при n2 = 7, 8, 9) в ультрафиолетовом.
То есть, видимые спектральные линии этой серии получаются, если электрон перескакивает на второй уровень (вторую орбиту): красная – с 3-ей орбиты, зеленая – с 4-ой орбиты, синяя – с 5-ой орбиты, фиолетовая – с 6-ой орбиты.
Переходы электронов с возбужденных энергетических уровней на третий (n1 = 3; соответственно n2 = 4, 5, 6, 7…) образуют серию Пашена. Все линии серии Пашена расположены в инфракрасном диапазоне.
Переходы электронов с возбужденных энергетических уровней на четвертый (n1 = 4; соответственно n2 = 6, 7, 8…) образуют серию Брэккета. Все линии серии находятся в далёком инфракрасном диапазоне.
Также в спектральных сериях водорода выделяют серии Пфунда и Хэмпфри.
Наблюдая линейчатый спектр атома водорода в видимой области (серию Бальмера) и измеряя длину волны λ спектральных линий этой серии, можно определить постоянную Планка.
В системе СИ расчетная формула для нахождения постоянной Планка при выполнении лабораторной работы примет вид:
 ,
,
где n1 = 2 (серия Бальмера); n2 = 3, 4, 5, 6.
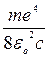 =3,2 × 10-93
=3,2 × 10-93
λ – длина волны (нм)
Постоянная Планка фигурирует во всех уравнениях и формулах квантовой механики. Она, в частности, определяет масштабы, начиная с которых вступает в силу принцип неопределенности Гейзенберга. Грубо говоря, постоянная Планка указывает нам нижний предел пространственных величин, после которого нельзя не принимать во внимание квантовые эффекты. Для песчинок, скажем, неопределенность произведения их линейного размера на скорость настолько незначительна, что ею можно пренебречь. Иными словами, постоянная Планка проводит границу между макромиром, где действуют законы механики Ньютона, и микромиром, где вступают в силу законы квантовой механики. Будучи получена всего лишь для теоретического описания единичного физического явления, постоянная Планка вскоре стала одной из фундаментальных констант теоретической физики, определяемых самой природой мироздания.