Постулаты Бора. Теория атома водорода по Бору. Расчет энергетических состояний атома водорода с точки зрения теории Бора.
Первый постулат Бора: Атомы могут длительное время находиться только в определенных, так называемых стационарных состояниях, в которых атом не излучает и не поглощает энергию. Энергии стационарных состояний 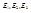 …образуют дискретный спектр.
…образуют дискретный спектр. 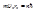 (2) Момент импульса электрона в этих состояниях должен быть целым кратным от постоянной Планка.
(2) Момент импульса электрона в этих состояниях должен быть целым кратным от постоянной Планка.
Второй постулат Бора: При переходе атома из одного начального стационарного состояния с энергией  в другое конечное состояние с энергией
в другое конечное состояние с энергией 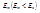 происходит излучение кванта света, причем
происходит излучение кванта света, причем 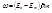 .
. 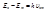 (3),
(3),
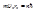 –условие орбит
–условие орбит
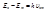 –условие частот
–условие частот
Электроны в атомах совершают орбитальное движение вокруг ядра под действием кулоновских сил. Но орбитами могут быть только стационарные, определяемые условиями квантования. Действует 2-ой закон Ньютона: 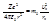 (4).
(4).
Совместное решение (2) и (3) дает: 
Зная 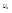 и
и 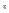 можно найти:
можно найти: 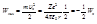 ,
,
 , можно найти полную энергию электрона в атоме водорода:
, можно найти полную энергию электрона в атоме водорода:
 (5).
(5).
Спектральные линии возникают при переходе электронов с одного уровня на другой (более низкий), а энергия, испускаемая квантом, равна разности энергий этих двух уровней:
 (6),
(6),
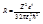 , здесь h - постоянная Планка, равная 6,625 *10-34 Дж.с. Из (6) и (13) следует, что длины волн спектральных линий атома водорода описываются формулой, аналогичной (1):
, здесь h - постоянная Планка, равная 6,625 *10-34 Дж.с. Из (6) и (13) следует, что длины волн спектральных линий атома водорода описываются формулой, аналогичной (1): 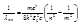 (7).
(7).
Cравнивая (1) и (7), можно вычислить постоянную Ридберга: 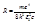 (8), где e - заряд электрона, m - его масса,
(8), где e - заряд электрона, m - его масса, 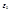 - электрическая постоянная, равная 8,85*10-12 Ф/м.
- электрическая постоянная, равная 8,85*10-12 Ф/м.
Расчет энергетических состояний атома водорода: 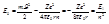
 эВ
эВ
Физический смысл спектральных линий – монохроматические излучения, возникающие в результате перехода атома в данное состояние из всех возможных возбужденных состояний, расположенных выше. На рис. изображены уровни энергии атома водорода, а стрелками обозначены переходы между уровнями, соответствующие спектральным линиям. Из рисунка видно, что линии в спектре водорода можно разложить по сериям: для всех линий серии, значение остается постоянным, а m может принимать значения любые от m= n+1 до 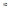 .
.
 |
В спектр испускания атома водорода входит несколько серий, расположенных в различных областях спектра:
а) серия Лаймана - крайняя ультрафиолетовая область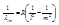 ,где n=1, m=2,3,.....
,где n=1, m=2,3,.....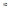 ;
;
б) серия Бальмера - видимая и близкая ультрафиолетовая область
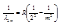 , где n=2, m=3,4,5,....
, где n=2, m=3,4,5,....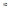 ;
;
в) серия Пашена - инфракрасная область спектра  , где n=3, m=4,5,6....
, где n=3, m=4,5,6....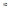 ;
;
г) серия Брэккета - инфракрасная область спектра 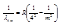 , где n=4, m=5,6,7,....
, где n=4, m=5,6,7,....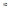 ;
;
д) серия Пфунда - инфракрасная область спектра 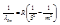 , где n=5, m=6,7,...
, где n=5, m=6,7,...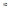 ;
;
Как видно из рисунка, головными линиями каждой серии являются линии, длины волн которых могут быть рассчитаны по формуле: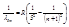 (9)
(9)
Переходы, обозначенные жирными линиями, соответствуют головным линиям серии и определяются формулой (9): переходы на заштрихованные уровни соответствуют границе серии и определяются формулой (7) , если в ней m=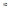 , то их длины волн выразятся формулой:
, то их длины волн выразятся формулой: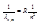 (10) Особый интерес представляет граница серии Лаймана. Зная частоту граничной серии Лаймана, можно определить энергию, необходимую для отрыва электрона от атома водорода, находящегося в нормальном или основном состоянии с n=1. Эта энергия называется энергией ионизации и вычисляется по формуле:
(10) Особый интерес представляет граница серии Лаймана. Зная частоту граничной серии Лаймана, можно определить энергию, необходимую для отрыва электрона от атома водорода, находящегося в нормальном или основном состоянии с n=1. Эта энергия называется энергией ионизации и вычисляется по формуле: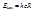
Метод квантования: орбиты электронов, соответствующие стационарным состояниям атомов, являются одними из возможных по классической механике орбит. Метод отбора орбит, соответствующих стационарным состояниям и называется методом квантования. Условие для круговых орбит: 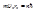 . Движение по эллипсу более сложное. Метод был обобщен Зоммерфильдом. Он показал, что квантовых условий должно быть столько, сколько степеней свободы имеет рассматриваемый тип движения. Под действием внешних воздействий эллиптическая орбита прецессирует и движение имеет три степени свободы. Зоммерфильд ввел еще два квантовых числа: l – орбитальное и m – магнитное квантовое число. l - орбитальное квантовое число, которое при заданном принимает значения l=0,1,...,n-1, т.е. всего n значений, и определяет момент импульса электрона в атоме и определяет форму орбиты. Главное квантовое число n определяет энергетические уровни электрона в атоме и может принять любые целочисленные значения, начиная с единицы: n=1,2,3,...
. Движение по эллипсу более сложное. Метод был обобщен Зоммерфильдом. Он показал, что квантовых условий должно быть столько, сколько степеней свободы имеет рассматриваемый тип движения. Под действием внешних воздействий эллиптическая орбита прецессирует и движение имеет три степени свободы. Зоммерфильд ввел еще два квантовых числа: l – орбитальное и m – магнитное квантовое число. l - орбитальное квантовое число, которое при заданном принимает значения l=0,1,...,n-1, т.е. всего n значений, и определяет момент импульса электрона в атоме и определяет форму орбиты. Главное квантовое число n определяет энергетические уровни электрона в атоме и может принять любые целочисленные значения, начиная с единицы: n=1,2,3,...  - магнитное квантовое число, которое при заданном может принимать значения
- магнитное квантовое число, которое при заданном может принимать значения 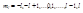 , т.е. всего 2 значений. Оно определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 2l+1 ориентаций.
, т.е. всего 2 значений. Оно определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 2l+1 ориентаций.
44. Пользуясь соотношением неопределённости Гейзенберга, оценить минимальную энергию электрона в атоме водорода.
В соответствии с принципом неопределённости неопределённость координаты электрона связана с неопределённостью импульса следующим соотношением: 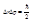
Формально энергия была бы минимальной при r=0 и p=0. Поэтому положим 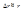 и
и 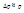 Подставив эти значения в 1 получим соотношение:
Подставив эти значения в 1 получим соотношение: 
(поскольку наши расчёты могут претендовать лишь на определение поряков вычисляемых величин, то мы половину в правой части опустили)
Энергия в атоме водорода равна:
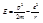
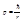
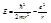 (*)
(*)
Найдём значение r, при котором Е минимальна. Продиффиренцировав последнее выражение по r и приравняв производную к нулю, получим уравнение

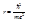
Подставим полученное нами значение для r в (*) получим выражение для минимальной энергии:
