Опыт Штерна и Герлаха.
С помощью опыта Штерна (1922) и Герлаха (измерение магнитного момента атома) было обнаружено пространственное квантование. Электрон вращается по замкнутой орбите (круг или эллирс) и должен иметь магнитный момент:  , где Т-период обращения S-площадь орбиты, которая равна:
, где Т-период обращения S-площадь орбиты, которая равна: 

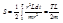
 , где L-механический момент
, где L-механический момент
Магнитный и механический моменты – вектора 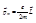
Для электрона в атоме их направления противоположны.
Если поместить атом в магнитное поле, то он начинает прецессировать (медленное вращение орбиты вокруг направления). Частота прецессии: 
 – магнетон Бора
– магнетон Бора
В опыте пучок атомов серебра (образованный в результате нагрева до высокой температуры в закрытом сосуде) выходит из маленького отверстия, коллимируется диафрагмами и пропускается через неоднородное магнитное поле (между полюсами магнита). При попадании на холодную пластину он осаждается на ней, при этом разделившись на два пучка и сконцентрировавшись около двух точек. Плотность отложений атомов пропорциональна интенсивности пучка и времени падения. Данные опыта говорят о том, что в электроне имеется два различных направления магнитного поля – спина. Ориентация магнитных моментов относительно магнитного поля изменяется дискретно – явление пространственного квантования, а позже выяснилось, что магнитный момент обусловлен внутренним магнитным моментом электрона, связанным с его внутренним механическим моментом. Этот внутренний момент электрона и носит название спина.
Спин-орбитальное взаимодействие – взаимодействие магнитного момента электрона с его орбитальным движением, т.е. внешним магнитным полем.
Мультиплетность – число возможных взаимных ориентаций спина электрона и его орбитального момента, т.е. число различных способов образования полного момента атома.
Атомы, имеющие два оптических электрона – щелочно-земельные металлы (He, Be, Mg, Ca). Полный момент атома у них обусловлен этими двумя электронами, т.к. остальные компенсируются. Полный спин (L+S) S=0,1, т.е соответствующие уровни триплетны.
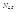 –число взаимных ориентировок. Есть два сорта атомов
–число взаимных ориентировок. Есть два сорта атомов
S=0  – энергетические уровни синглетны
– энергетические уровни синглетны
S=1  – уровни триплетны
– уровни триплетны
Это можно рассмотреть на примере парагелия (уровни синглетны, спины ориентированы в разных направлениях) и ортогелия (уровни триплетны, спины в одном направлении). Термы с различной мультиплетностью не комбинируются. Ортогелий не может превратиться в парагелий (правило отбора). Спектр парагелия образуется в результате переходов между синглетными уровнями и состоит из синглетных линий. Ортогелий – переходы между триплетными уровнями.
Атомы с тремя оптическими электронами.
S=1/2–термы дублетные
S=3/2 – мультиплетность равна 2*(3/2)+1=4 – термы-квартеты.
Правило мультиплетности – термы атомов или ионов с четным числом электронов имеют нечетные мультиплетности, с нечетным – четное.