Застройка электронных оболочек. Периодическая система элементов Менделеева.
Положение электронов в атоме описывается набором 4-х квантовых чисел (l, m, n, s), которые получаются при решении уравнения Шредингера или уравнения Дирака. Согласно законам релятивистской механики n, l, m, s описывают:
n – энергию; 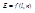
l – орбитальный механический момент; 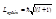
m – проекцию орбитального момента; 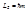
s – собственный механический момент. 
В 1869 г. Менделеев открыл периодический закон изменения химических и физических свойств элементов в зависимости от их аомных масс. Теория периодической системы основывается на следующих положениях:
- порядковый номер химического элемента равен общему числу электронов в атоме данного элемента;
- состояние электронов в атоме определяется набором из квантовых чисел n, m, l, s. Распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние с наименьшей энергией;
- заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули: в любой квантово-механической системе не может быть двух одинаковых электронов, состояния которых описывались бы одинаковым набором квантовых чисел.
Электроны в атоме, занимающие совокупность состояний с одинаковым значением квантового числа n, образуют электронный слой. В зависимости от значений n различают следующие слои:
К при n=1, L при n=3, M при n=3, N при n=4, O при n=5 и т. д.
Максимальное число электронов, которые могут находиться в слое:  .
.
В каждом из слоев электроны распределяются по оболочкам, каждая из которых соответствует определенному значению орбитального квантового числа l. Максимальное число электронов, определенных орбитальным квантовым числом: 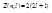 .
.
Электронная конфигурация задается: 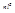 , где z – число эквивалентных электронов (с одинаковыми квантовыми числами
, где z – число эквивалентных электронов (с одинаковыми квантовыми числами 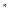 и
и 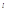 .
.