Молекулярные диполи

В этой главе мы поговорим о том, почему вещество бывает диэлектриком. В предыдущей главе мы указывали, что свойства электрических систем с диэлектриками можно было бы понять, предположив, что электрическое поле, действуя на диэлектрик, индуцирует в атомах дипольный момент. Именно, если электрическое поле Е индуцирует средний дипольный момент в единице объема Р, то диэлектрическая проницаемость х дается выражением
(11.1)
О применениях этого выражения мы уже говорили; сейчас же нам нужно обсудить механизм возникновения поляризации внутри материала под действием электрического поля. Начнем с самого простого примера — поляризации газов. Но даже в газах возникают сложности: существуют два типа газов. Молекулы некоторых газов, например кислорода, в каждой молекуле которого имеются два симметричных атома, лишены собственного дипольного момента. Зато молекулы других газов, вроде водяного пара (у которого атомы водорода и кислорода образуют несимметричную молекулу), обладают постоянным электрическим дипольным моментом. Как мы отмечали в гл. 6 и 7, в молекуле водяного пара атомы водорода в среднем имеют положительный заряд, а атом кислорода — отрицательный. Поскольку центры тяжести положительного и отрицательного зарядов не совпадают, то распределение всего заряда в молекуле обладает дипольным моментом.
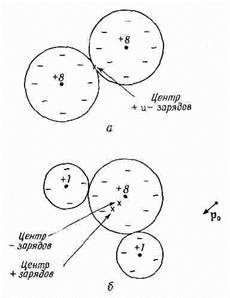
Фиг. 11.1. Молекула кислорода с нулевым дипольным моментом (а) и молекула воды с постоянным дипольным моментом р0 (б).
Такая молекула называется полярной молекулой. А у кислорода вследствие симметрии молекулы центр тяжести и положительных, и отрицательных зарядов один и тот же, так что это неполярная молекула. Она, правда,
может стать диполем, если ее поместить в электрическое поле. Формы этих двух типов молекул нарисованы на фиг. 11.1.