Изменение термодинамического потенциала в зависимости от температуры для металла в твердом и жидком состояниях
Температура, при которой термодинамические потенциалы вещества в твердом и жидком состояниях равны, называется равновесной температурой кристаллизации. Кристаллизация происходит в том случае, если термодинамический потенциал вещества в твердом состоянии будет меньше термодинамического потенциала вещества в жидком состоянии, т. е. при переохлаждении жидкого металла до температур ниже равновесной. Плавление - процесс, обратный кристаллизации, происходит при температуре выше равновесной, т. е. при перегреве. Разница между реальными температурами плавления и кристаллизации называется температурным гистерезисом.
Поскольку жидкий металл с присущим ему ближним порядком в расположении атомов обладает большей внутренней энергией, чем твердый со структурой дальнего порядка, при кристаллизации выделяется теплота. Между теплотой и температурой кристаллизации Тк существует определенная связь. Так как при равновесной температуре кристаллизации термодинамические потенциалы в жидком и твердом состояниях равны, то
|
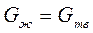 =>
=> 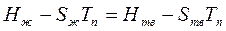 =>
=>
Параметр ΔS = Q/TK характеризует упорядоченность в расположении атомов при кристаллизации. В зависимости от сил межатомной связи теплота кристаллизации для различных металлов изменяется от 2500 Дж/моль (Na, К и др.) до 20000 Дж/моль (W и др.).
Когда кристаллизуется чистый элемент, отвод теплоты, происходящий вследствие охлаждения, компенсируется теплотой кристаллизации. В связи с этим на кривой охлаждения, изображаемой в координатах температура-время, процессу кристаллизации соответствует горизонтальный участок:

