Уравнение состояния идеального газа. Универсальная газовая постоянная
На основании законов Бойля-Мариотта и Гей-Люсака в 1834г Клапейроном было выведено уравнение состояния идеальных газов.
Из уравнений (1.1) и (1.2) следует, что p = n k T , (2.14)
Уравнение (2.14) наз. основным уравнением кинетической теории газов. Рассмотрим
1 кг газа. Учитывая, что в нём содержится N молекул и, следовательно, n = N/v
получим: p v = N k T , (2.15)
Постоянную величину N k, отнесённую к 1 кг газа, обозначают буквой R и наз. газовой постоянной, R,(Дж/кг К).
Поэтому p v = R T , (2.16)
Это уравнение наз. уравнением Клапейрона.
Умножив уравнение (2.16) на массу m, получим уравнение состояния для произвольной массы газа: pv=mRT , (2.17)
Уравнение Клапейрона принимает универсальную форму, если газовую постоянную отнести не к 1 кг, а 1 кмолю газа.
Умножая обе части уравнения (2.16) на молекулярную массу, получим:
р v 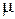 =
= 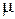 R T, (2.18) или p V
R T, (2.18) или p V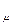 = R
= R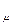 T, (2.19)
T, (2.19)
где V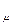 -молярный объём газа, м3/кмоль; R
-молярный объём газа, м3/кмоль; R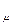 -универсальная газовая постоянная, (Дж/(кмоль К)), где:
-универсальная газовая постоянная, (Дж/(кмоль К)), где: 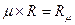
Уравнение (2.19) в 1874г. получено Д. И. Менделеевым и носит название уравнения состояния для 1кмоля газа или уравнения Менделеева – Клапейрона.
Универсальная газовая постоянная R , входящая в уравнение (2.19) не зависит от
, входящая в уравнение (2.19) не зависит от
природы вещества и для всех идеальных газов в любом состоянии имеет одно и то же значение. Она может быть вычислена из уравнения (2.19). Так при нормальных физических условиях (НФУ) – это такие, при которых р =101325 Па = 760 мм рт. ст; Т = =273,15 К; V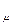 = 22,4 м3 /кмоль.
= 22,4 м3 /кмоль.
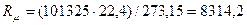 , Дж/(кмоль К), (2.20)
, Дж/(кмоль К), (2.20)