Энтальпия рабочего тела как функция состояния
Термин энтальпия (от греч. euthalpo – нагреваю) введен в 1909 г. Камерлинг-Онессом.
В ТТД важную роль играет величина суммы внутренней энергии U системы и произведения давления системы р на величину объема V системы, наз. энтальпией ( Н), Дж.
Н = U +pV, (3.8)
Удельная энтальпия h=H/m представляет собой энтальпию системы, содержащей 1кг вещества, и измеряется в Дж/кг.
Чтобы лучше уяснить смысл энтальпии, рассмотрим полную энергию газа, находящегося под давлением р в цилиндрическом сосуде с поршнем. (рис.3.2)
Его давление (газа) уравновешивается грузом весом pF. Площадь поршня F, высота его расположения у. Полная энергия термодинамической системы Е, состоящей из газа и поршня с грузом, складывается из внутренней энергии газа U и потенциальной энергии поршня с грузом, равной pFy=pV, так что Е = U + pV = H , (3.9)
где pV – характеризует потенциальную энергию противодавления газа внешнему давлению (в данном примере – груза G=pF), т.е. член pV численно равен работе,
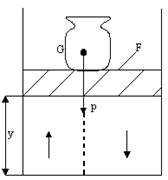 которую нужно совершить, чтобы ввести объем газа из вакуума в пространство с давлением р.
которую нужно совершить, чтобы ввести объем газа из вакуума в пространство с давлением р.
Т.к. входящие в уравнение (3.9) величины явл. функциями состояния, то и сама энтальпия явл. функцией состояния и поэтому может быть представлена в виде функции любых двух параметров состояния: H=f1 (p,v); H=f2 (p,T); H=f3 (v,T)
Для реального газа энтальпия зависит от давления и температуры h= f (p,T)
Для идеального газа энтальпия, как и внутренняя энергия явл. функцией только абсолютной температуры, т.е.:
H = U + pV = U (T) + RT = H (T), (3.10)
Уравнение 1-го закона ТТД в случае, когда единственным видом работы явл. работа расширения: 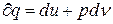 , с
, с
Рис. 3.2 учетом отношения 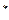 pdv=d (pv) – v (dp) может быть записано в виде:
pdv=d (pv) – v (dp) может быть записано в виде: 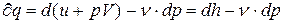 , (3.11)
, (3.11)
из этого соотношения следует, что если давление системы сохраняется неизменным, то
теплота, подведенная в изобарном процессе к системе, расходуется только на изменение энтальпии данной системы.
Т.к. энтальпия идеального газа, так же как и внутренняя энергия идеального газа, зависит только от температуры, и, следовательно: 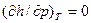 ,
, 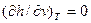 , то выражение (3.14) для идеального газа запишется:
, то выражение (3.14) для идеального газа запишется: 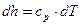 , (3.12)
, (3.12)
 |
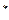 Преобразование типа: xdy=d(xy) – ydx наз. преобразованием Лежандра.
Преобразование типа: xdy=d(xy) – ydx наз. преобразованием Лежандра.