Анализ обобщающего значения политропного процесса
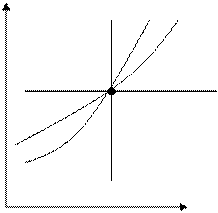
Для определения закона, по которому в p,v-; T,S-диаграммах располагаются политропы, выходящие из одной точки, рассмотрим графики частных процессов изменения состояния газов в указанных диаграммах. (рис. 4.5):
Из этих графиков следует, что в p,v – диаграмме политропы при расширении газа располагаются тем круче, чем больше их показатель n. При сжатии газа наблюдается обратная закономерность: политропы, выходящие из одной точки, располагаются тем более полого, чем меньше их n.
n=0 q>0
нагр.
n=k n= n=k
n=k
сж. расш.
v S Рис. 4.5
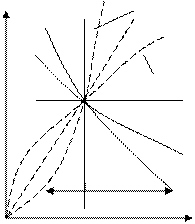
Обратим внимание, что линии простых (частных) процессов разделяют все возможные процессы, проходящие через одну и ту же начальную точку, по некоторым типичным причинам.
Изохора 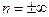 делит все процессы на две группы. Все процессы, политропы которых расположены правее изохоры, характеризуют расширение газа, левее – сжатие.
делит все процессы на две группы. Все процессы, политропы которых расположены правее изохоры, характеризуют расширение газа, левее – сжатие.
Изобара (n=0) также делит кривые всех политропных процессов на 2 группы. Кривые, расположенные ниже изобары, характеризуют процессы с уменьшением давления, а выше изобары – с увеличением давления.
Изотерма (n=1) также делит все процессы на 2 группы. Все процессы, расположенные выше изотермы, протекают с увеличением внутренней энергии (с ростом температуры), а ниже изотермы - с уменьшением внутренней энергии (с уменьшением температуры).
Адиабата (n=k) делит все процесы на 2 группы. Политропы, расположенные выше адиабаты, протекают с подводом теплоты, а ниже ее – с отводом теплоты.
При 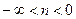 политропы в p,v – диаграмме представляют собой кривые, обозначеные пунктиром (рис.4.11), проходящие через начало координат, причем при n>-1 кривая направлена выпуклостью вверх, а при n<-1 – выпуклостью вниз; при n=1 политропа представляет собой прямую линию.
политропы в p,v – диаграмме представляют собой кривые, обозначеные пунктиром (рис.4.11), проходящие через начало координат, причем при n>-1 кривая направлена выпуклостью вверх, а при n<-1 – выпуклостью вниз; при n=1 политропа представляет собой прямую линию.
При 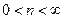 политропы имееют в p,v – диаграмме гиперболический характер.
политропы имееют в p,v – диаграмме гиперболический характер.
На основании изложенного следует, что положительная работа будет совершаться во всех политропных процессах, для которых т.2 будет располагаться правее т.1 на p,v – диаграмме.
Количество теплоты будет положительным, т.е. оно будет сообщаться газу во всех политропных процессах, для которых т.2 будет располагаться правее т.1 на p,v – диаграмме.
Внутренняя энергия будет возрастать для всех политропных процессов, у которых т.2 будет располагаться выше т.1 на T,S – диаграмме.