Уравнение состояния реального газа или уравнение Ван-дер-Ваальса
Одной из первых попыток в этой области была разработка голландского физика Н. Ван-дер-Ваальса в 1873 г. Это уравнение он получил на основе кинетической теории газов; учитывая объем самих молекул и силы взаимодействия между ними, уравнение имеет следующий вид: 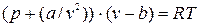 , (9.1)
, (9.1)
где а и b - константы, которые наряду с газовой постоянной характеризуют индивидуальные свойства вещества. Для данного газа они постоянны.
Одна поправка учитывает объем, недоступный для движения молекул в силу конечности объема самих молекул и наличия взаимодействия между ними. При беспредельном сжатии газа его объем будет стремиться не к нулю, как у идеальных газов, а к некоторому предельно малому объему b. Величина b больше суммарного объема молекул, так как в связи с наличием сил отталкивания, возникающих при их сближении, молекулы газа при сжатии его не могут быть доведены до соприкосновения. Величина b явл. суммарным объемом сферических оболочек, в пределы которых не могут проникнуть другие молекулы, и составляет примерно учетверенный объем самих молекул. В связи с этим в уравнение состояния следует вводить не полный объем газа v, а лишь свободный объем (v-b).
Другая поправка учитывает силы взаимного притяжения, действующие в направлении действия внешнего давления и как бы увеличивающая его на некоторую добавочную величину, наз. внутренним давлением. Полагая, что внутреннее давление газа изменяется пропорционально квадрату плотности или обратно пропорционально квадрату удельного объема газа, Ван-дер-Ваальс принял его равным 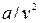 . Это отношение для жидких тел имеет большое значение (например для воды оно при 20
. Это отношение для жидких тел имеет большое значение (например для воды оно при 20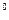 С составляет 1050 Мпа); для газов из-за малых сил сцепления оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на ее объем, и жидкость считают практически несжимаемой. В газах, ввиду малости
С составляет 1050 Мпа); для газов из-за малых сил сцепления оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на ее объем, и жидкость считают практически несжимаемой. В газах, ввиду малости 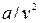 внешнее давление легко изменяет их объем.
внешнее давление легко изменяет их объем.
Таким образом, уравнение Ван-дер-Ваальса учитывает реальные свойства газа – наличие межмолекулярных взаимодействий в газах и собственный объем молекул.