Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний. Критические параметры вещества - Лекция, раздел Физика, ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Особенно Интересно Уравнение Ван-Дер-Вааль...
Особенно интересно уравнение Ван-дер-Ваальса (9.1) тем, что оно качественно отображает главную особенность реальных газов – способность переходить при определенных условиях в жидкое состояние. Наглядное представление об этом получается, если преобразовать его в уравнение 3-ей степени относительно V. Для этого в ур-ии (9.1) раскроем в левой части скобки: 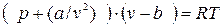 ,
,
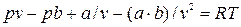
Умножив обе стороны равенства на v и разделив на р, получаем после приведения подобных членов:
и разделив на р, получаем после приведения подобных членов: 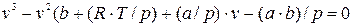 , (9.5)
, (9.5)
Полученное уравнение имеет три корня, т.е. при заданных параметрах p и Т здесь возможны три случая: один корень действительный и два мнимых; все три корня действительные и различные; все три корня действительные и равные.
Рассмотрим в системе координат p-v изотермы, построенные по приведенному уравнению Ван-дер-Ваальса, для разных температур. (рис. 9.2).
Из рисунка видно, что вид изотерм меняется в зависимости от температуры.
Первый случай имеет место при высоких температурах, когда изотермы имеют вид гиперболического характера (например, линия 1-2). В этом случае каждому давлению соответствует вполне определенный удельный объем (например, давлению р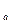 соответствует удельный объем v
соответствует удельный объем v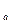 ). Это значение удельного объема и является действительным корнем уравнения (9.1), оба же мнимых корня в этом случае физического смысла не имеют и должны быть отброшены. Тело в этом случае при любых давлениях находится в газообразном состоянии. Это так наз. сверхкритические изотермы вандерваальского газа, т.е. изотермы при Т>T
). Это значение удельного объема и является действительным корнем уравнения (9.1), оба же мнимых корня в этом случае физического смысла не имеют и должны быть отброшены. Тело в этом случае при любых давлениях находится в газообразном состоянии. Это так наз. сверхкритические изотермы вандерваальского газа, т.е. изотермы при Т>T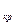 .
.
Второй случай имеет место при сравнительно низких температурах, когда изотермы имеют два перегиба (например, линия 3-4). Это так наз. докритическая область, у которой Т<T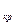 . На изотермах одному значению давления р соответствует три значения удельного объема (например, давлению р
. На изотермах одному значению давления р соответствует три значения удельного объема (например, давлению р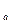 соответствуют удельные объемы v
соответствуют удельные объемы v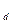 , v
, v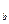 , v
, v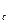 ), которые и являются тремя действительными и различными корнями уравнения (9.1). Участок 3-b соответствует изотермическому сжатию тела, находящегося в газообразном состоянии, причем в точке b оно уже начинает переходить в жидкое состояние. Точка d соответствует такому состоянию, когда оно уже полностью превратилось в жидкость, в соответствие с чем участок d-4 представляет собой изотермическое сжатие жидкости. Точка с соответствует промежуточному двухфазному состоянию тела. Участок кривой b-f соответствует неустойчивому состоянию переохлажденного пара, а участок d-e, также неустойчивому состоянию перегретой жидкости. Что же касается участка e-f, то он вообще физического смысла не имеет, поскольку в действительности при изотермическом сжатии тело переходит из газообразного в жидкое состояние при постоянном давлении, т.е. по горизонтальной линии b-d.
), которые и являются тремя действительными и различными корнями уравнения (9.1). Участок 3-b соответствует изотермическому сжатию тела, находящегося в газообразном состоянии, причем в точке b оно уже начинает переходить в жидкое состояние. Точка d соответствует такому состоянию, когда оно уже полностью превратилось в жидкость, в соответствие с чем участок d-4 представляет собой изотермическое сжатие жидкости. Точка с соответствует промежуточному двухфазному состоянию тела. Участок кривой b-f соответствует неустойчивому состоянию переохлажденного пара, а участок d-e, также неустойчивому состоянию перегретой жидкости. Что же касается участка e-f, то он вообще физического смысла не имеет, поскольку в действительности при изотермическом сжатии тело переходит из газообразного в жидкое состояние при постоянном давлении, т.е. по горизонтальной линии b-d.
Третий случай имеет место при вполне определенной для каждого тела температуре, когда т.b и d, сближаясь с повышением температуры, сливаются в одну т.К, в которой имеет место перегиб соответствующей изотермы, причем касательная к ней в этой точке имеет горизонтальное направление. Для изотермы Т=Т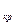 характерно наличие точки перегиба К , в которой удельные объемы v
характерно наличие точки перегиба К , в которой удельные объемы v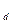 , v
, v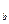 , v
, v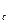 совпадают, т.е. три действительные корня равны.
совпадают, т.е. три действительные корня равны.
Участок d-e и f-b на изотермах можно воспроизвести экспериментально только для «чистых» жидкостей и паров, из которых предварительно удалены воздух и чистые примеси. Участок d-e соответствует метастабильному состоянию жидкости (перегретая жидкость). Жидкость, из которой удалены растворенные в ней газы, при спокойном нагревании без колебаний в сосуде можно перегревать. Состояние перегретой жидкости неустойчиво. Малейшее возмущение (встряхивание) вызывает вскипание и переход процесса на линию d-b. Участок f-b соответствует метастабильному состоянию пара (переохлажденный пар). Экспериментально его можно получить, если очистить пар от пылинок и других загрязнений, вокруг которых начинают образовываться капельки жидкости. Конденсация задерживается, и пар перенасыщается. Состояние пара на участке f-b также неустойчиво. Появление любых центров конденсации быстро вызывает расслоение пара на две фазы, в результате чего процесс переходит на линию d-b. Точки на участке e-c-f изотермы экспериментально обнаружить не удается.
Точка К наз. критической точкой, а соответствующие ей параметры р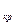 , v
, v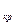 , Т
, Т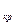 наз. критическими параметрами.
наз. критическими параметрами.
Критическая температура, существование которой было открыто в 1861г. Д.И. Менделеевым, характеризуется тем, что при температурах выше нее невозможно путем изотермического сжатия добиться перехода газа в жидкое состояние.
Аналитически условия критического состояния тела выражаются уравнениями:
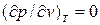
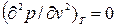 , (9.6)
, (9.6)
Первое из них показывает, что критическая изотерма в точке К имеет горизонтальную касательную, второе – что изотерма имеет в т.К перегиб.
Используя эти уравнения совместно с уравнениями состояния, можно определить значения критических параметров состояния газа.
Применительно к уравнению Ван-дер-Ваальса, критические параметры определяются следующим образом.
В уравнении (9.1) оставим переменную р в левой части, а переменную V перенесем в правую часть: 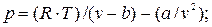
Дифференцируя это выражение по V, считая, что Т=const, и приравнивая полученное выражение к нулю: 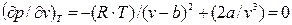 , (9.7)
, (9.7)
Определяем вторую производную и тоже приравниваем ее к нулю:
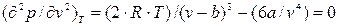 , (9.8)
, (9.8)
Для нахождения критических параметров следует решить совместно имеющиеся три уравнения (9.1), (9.7), (9.8). Представив два последних уравнения в виде:
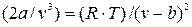 и
и 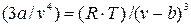
Затем, разделив первое из них на второе, получим:
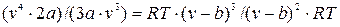 или 2v=3v-3b;
или 2v=3v-3b;
и, следовательно: 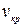 =3b , (9.9)
=3b , (9.9)
Подставив полученное значение в (9.7), получим:
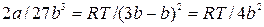
Откуда: 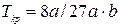 , (9.10)
, (9.10)
Далее, подставляя в уравнение (9.1) найденные значения v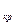 и Т
и Т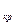 , получаем:
, получаем:
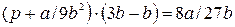
Откуда: 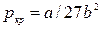 , (9.11)
, (9.11)
9.4. p, v, T – диаграмма при фазовых переходах жидкости и газа
Известно, что любое вещество в зависимости от давления и температуры может находиться в различных агрегатных состояниях (фазах): газообразном, жидком и твердом. Вещества в различных агрегатных состояниях имеют различные свойства, что объясняется характером межмолекулярного взаимодействия. Переход вещества из одного агрегатного состояния в другое, сосуществующее с первым, наз. фазовым переходом или фазовым превращением. Отличительной особенностью фазовых переходов является скачкообразное изменение плотности, удельной энтропии и других свойств веществ. Фазовые переходы могут проходить с поглощением или выделением теплоты. Переход вещества из одной фазы в другую, происходящий при Т=const и p=const до полного исчезновения этой фазы, наз. равновесным фазовым переходом. Равновесное состояние термодинамической системы, состоящей из двух или большего числа фаз, наз фазовым равновесием. Фазовый переход из жидкого или газообразного состояния в кристаллическое наз. кристаллизацией, а обратный переход из кристаллического состояния в жидкое – плавлением, а непосредственно в газообразное (парообразное) наз. сублимацией, а обратный переход – десублимацией. Фазовый переход вещества из жидкого состояния в состояние пара наз. парообразованием, а обратный переход из парообразного состояния в жидкое (или кристаллическое) – конденсацией.
На рис. 9.4 приведена р, Т – диаграмма состояния воды с нанесенными на ней кривыми фазовых переходов.
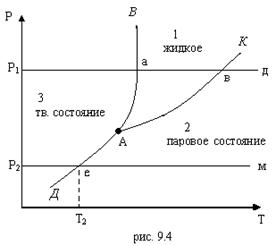 Из рисунка видно, что кривые АВ, АК, АД делят р,Т – диагр. на три области: 1 – область жидкого состояния (вода), 2 – область парообразного состояния (пар), 3 – область твердого состояния – лед. Кривая АВ характеризует равновесное состояние жидкой и твердой фаз. Она определяет зависимость температуры плавления от давления и разделяет области твердого и жидкого состояний. Эта кривая наз. кривой плавления. Кривая АК представляет собой кривую кипения (конденсации), которая характеризует состояние жидкой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой кипения р=f (ts). Кривую кипения обычно называют кривой или линией насыщения. Линия АД, являющаяся кривой сублимации, характеризует равновесное состояние твердой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой возгонки и сублимации р=f (ts). Точки на этой кривой соответствуют двухфазной системе лед-пар. Точка А пересечения двух кривых фазового равновесия представляет собой тройную точку, в которой одновременно сосуществуют три фазы: вода, пар и лед. Вид кривых АВ, АК и АД и их расположение на р,Т – диагр. зависит от природы веществ. Для воды кривая плавления АВ, вследствие ее аномальных свойств, имеет наклон влево, т.е. с повышением давления температура плавления льда уменьшается.
Из рисунка видно, что кривые АВ, АК, АД делят р,Т – диагр. на три области: 1 – область жидкого состояния (вода), 2 – область парообразного состояния (пар), 3 – область твердого состояния – лед. Кривая АВ характеризует равновесное состояние жидкой и твердой фаз. Она определяет зависимость температуры плавления от давления и разделяет области твердого и жидкого состояний. Эта кривая наз. кривой плавления. Кривая АК представляет собой кривую кипения (конденсации), которая характеризует состояние жидкой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой кипения р=f (ts). Кривую кипения обычно называют кривой или линией насыщения. Линия АД, являющаяся кривой сублимации, характеризует равновесное состояние твердой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой возгонки и сублимации р=f (ts). Точки на этой кривой соответствуют двухфазной системе лед-пар. Точка А пересечения двух кривых фазового равновесия представляет собой тройную точку, в которой одновременно сосуществуют три фазы: вода, пар и лед. Вид кривых АВ, АК и АД и их расположение на р,Т – диагр. зависит от природы веществ. Для воды кривая плавления АВ, вследствие ее аномальных свойств, имеет наклон влево, т.е. с повышением давления температура плавления льда уменьшается.
Кроме того, на рис. 9.4 показано как изменяется состояние вещества, если его нагреть при постоянном давлении р1 (р1> ра). Изобара р1-а-в-д характеризует процесс перехода твердого вещества в перегретый пар. На участке изобары р1-а происходит нагревание твердого вещества. В точке (а) на кривой плавления АВ оно превращается в жидкость. Температура, при которой осуществляется это фазовое превращение, наз. температурой плавления, а количество подводимой теплоты – скрытой теплотой плавления. Отрезок изобары а-в характеризует процесс нагревания жидкости. В точке (в), расположенной на кривой АК, жидкость превращается в пар. Дальнейшее продвижение по изобаре от точки (в) к точке (д) соответствует нагреванию пара. В точке (д) содержится перегретый пар.
Из р,Т – диагр. видно, что кривая насыщения АК в верхней части заканчивается критической точкой К. Выше критической точки переход их жидкого состояния в пар происходит непосредственно, минуя стадию двухфазного состояния.
Из этой же диагр. видно, что при Т>Ткр никаким изотермическим сжатием невозможно перевести пар в жидкость. Если нагревание твердого вещества проводить по изобаре р2-е-м (р2<ра), то при температуре Т2 (точка е на кривой АД) вещество переходит из твердого состояния в газообразное, минуя жидкость.
На рис. 9.5 приведены фазовые состояния вещества в р,v - , Т, v - , p, S - и T, S – диаграммах. На этих диаграммах область равновесия двух фаз изображается не одной линией, (как в р,Т – диаграмме), а представляет собой соответствующие площади диаграммы, разделенные линиями, которые наз. пограничными кривыми.
На приведенных диаграммах область 1 представляет собой твердую фазу, область 2 – равновесное состояние твердой и жидкой фаз, 3 – жидкую фазу, 4 – равновесное состояние жидкой и газообразной фаз, область 5 – газообразную фазу, 6 – равновесное состояние твердой и газообразной фаз, отрезок б-с-д – состояние, соответствующее тройной точке,
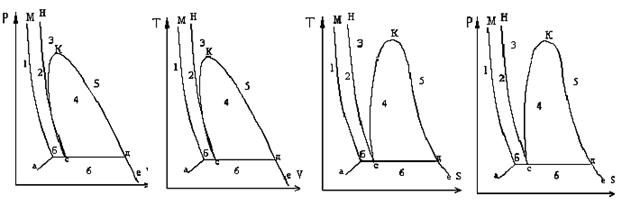
рис.9.5
т.е. в p,v - , T,v – и p,S - , T,S – диаграммах тройная точка оказывается развернутой в линию. Точка К явл. критической точкой вещества, линии с-К и К-д – левой и правой пограничными кривыми двухфазной области жидкость – пар. Линия с-К наз. пограничной кривой жидкости. В каждой точке этой кривой жидкость находится в равновесии со своим насыщенным паром, массовая доля жидкости равна единице. Насыщенный пар – это пар, находящийся в равновесном состоянии с жидкостью, из которой он образуется. Кривая К-д – пограничная кривая пара. В каждой точке этой кривой массовая доля пара равна единице. Отрезки б-м и с-н – кривые двухфазной области твердая фаза – жидкость (кривая плавления). Отрезки а-б и д-е – кривые двухфазной области твердая фаза – пар (кривая сублимации).
Все темы данного раздела:
Техническая термодинамика как теоретическая основа теплоэнергетики
Наиболее актуальные задачи, которые решают с использованием термодинамики: создание летательных аппаратов, в том числе космических многоразового действия; проектирование тепловых и
Термодинамическая система. Рабочее тело. Внешняя среда
Термодинамической системой называют совокупность материальных тел, (а также полей) находящихся в механическом и тепловом взаимодействии, а также обменивающихся друг с другом вещест
Термические параметры состояния
Абсолютная температура (T) характеризует тепловое состояние тела, или, как иногда говорят, степень нагретости тела.
С точки зрения молекулярно-кинетической теории температ
Абсолютное давление (p )
Абсолютное давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела, действующего по нормали
Термические коэффициенты
Как известно, каждый из основных параметров состояния системы p, v, T является функцией двух других ее параметров:
;
Уравнение состояния
Если все термодинамические параметры состояния постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным. Если межд
Термодинамический процесс. Равновесный и неравновесный необратимый процессы. Круговые процессы (циклы)
В результате взаимодействия термодинамической системы с окружающей средой (подвод к телу теплоты или работы) состояние рабочего тела, определяемое параметрами, изменяется
С
Теплота и работа как формы передачи энергии
Теплота и работа представляют две формы передачи энергии от одного тела (или системы) к другому.
Процесс работы – макроскопический, который представляет собой упорядоченную
Термодинамика идеального газа
Под идеальным газом понимают совокупность материальных вполне упругих молекул, обладающих пренебрежимо малыми объёмами, находящихся в состоянии хаотического движения и лишённых сил
Основные законы идеальных газов
Закон Бойля - Мариотта.(изотермический процесс)
В 1662 г. Р. Бойль , а в 1676 г. Э. Мариотт независимо друг от друга установили зависимость опытным путем объёма газа от ег
Уравнение состояния идеального газа. Универсальная газовая постоянная
На основании законов Бойля-Мариотта и Гей-Люсака в 1834г Клапейроном было выведено уравнение состояния идеальных газов.
Из уравнений (1.1) и (1.2) следует, что p = n k T , (2.14)
Смеси идеальных газов. Закон Дальтона
В ТТД чистым веществом наз. вещество, все молекулы которого одинаковы. Смесь, состоящая из нескольких чистых веществ наз. раствором. Чистыми веществами явл., напри
Внутренняя энергия как функция состояния рабочего тела
Внутренняя энергия обозначается буквой U, ее размерность Дж.
Внутренняя энергия включает в себя:
1. Кинетическую энергию поступательного, вращательного и к
Энтальпия рабочего тела как функция состояния
Термин энтальпия (от греч. euthalpo – нагреваю) введен в 1909 г. Камерлинг-Онессом.
В ТТД важную роль играет величина суммы внутренней энергии U системы и произведения дав
Аналитическое выражение 1-го закона ТТД
Первое начало ТТД представляет собой частный случай всеобщего закона сохранения и превращения энергииприменительно к тепловым явлениям.
Энтропия как параметр состояния термодинамической системы
Термин энтропия (от греч. entropia – мера превращений ) введен в 1865 году Клаузиусом.
Понятие об энтропии строится на основе следующих соображений.
Уравнение 1-г
Уравнение Майера
В соответствии с 1 – ым законом ТТД для закрытых систем имеем:
С учетом соотношения (3.4.а), подставив его в выражение 1-го
Основные термодинамические процессы идеальных газов
ТД анализ любой системы состоит в следующем:
1. Выявить уравнение процесса. 2. Установить аналитическую взаимосвязь между
параметрами состояния, (связь между парам
Политропный процесс
Политропными процессами наз. процессы, протекающие при постоянной теплоемкости и вызываемые подводом или отводом теплоты. Следовательно, в любом политропном процессе, распределение
Изохорный процесс
Процесс, в котором не изменяется объем наз. изохорным. Линия, изображающая изохорный процесс, наз. изохорой. Этот процесс соответствует закону Шарля.
Графическая интерпрет
Изобарный процесс
При изобарном процессе выполняется условие p=const и dp=0. Этот процесс
соответствует закону Гей-Люссака (рис.4.2).
При р=cоnst с=cp , откуда
Работа изменения объема в изобарном процессе.
Работа в изобарном процессе определяется интегрированием выражения при p=const: , (4.17)
Следовательно, работа газа в изобарн
Изотермический процесс
При изотермическом процессе выполняется условие: dT=0 или T=const.
Таким образом следует, что это возможно, если .
Н
Адиабатный процесс
При адиабатном процессе теплообмен рабочего тела с окружающей средой отсутствует, т.е. рабочее тело предполагается изолированным от окружающей среды идеальной тепловой изоляцией.
Анализ обобщающего значения политропного процесса
Для определения закона, по которому в p,v-; T,S-диаграммах располагаются политропы, выходящие из одной точки, рассмотрим графики частных процессов изменения состояния
Политропные процессы по особенностям превращения энергии можно разбить на 3 группы.
Первая группа: . Построим в p,v и T,S – диаграммах политропные процессы с предельными значениями показателя R данной группы. То
Сущность 2-го закона ТТД
Первым законом ТТД устанавливаются лишь количественные соотношения при взаимных превращениях теплоты и работы.
В частности, при теплообмене можно было бы предположить, что теплота может пе
Термический КПД и холодильный коэффициент циклов
Исследование любого прямого цикла показывает, что для получения положительной работы необходимо к рабочему телу на некотором участке цикла подвести теплоту q1 от внешнего
Прямой и обратный циклы Карно
В 1824 французский инженер С. Карно предложил цикл идеального теплового двигателя, состоящий из двух изотерм и двух адиабат и представляющий собой замкнутый процесс, который
Математическое выражение второго закона ТТД
Для обратимого цикла Карно имеем ;откуда
Необратимые циклы
Термический КПД необратимого цикла меньше, чем термический КПД цикла Карно, т.е.
ηtннеоб<ηооб и
Объединенные уравнения 1-го и II-го законов термодинамики
Как известно, аналитически II закон ТТД выражается в следующем виде:
или
Изменение энтропии в необратимых термодинамических процессах изолированных систем
Рассмотрим принципиальное отличие необратимых процессов от обратимых на примере расширения газа в цилиндре под поршнем (рис 6.2), получающего теплоту
Производство работы. Полезная работа. Максимальная работа. Максимальная полезная работа
Если рабочее тело находится в состоянии, отличном от того, которое оно имеет при параметрах окружающей среды (т.е. система не находится в равновесии), то в принципе это раб. тело может произвести р
Понятие об эксергии. Уравнение Гюи-Стодолы
Термин «эксергия» в 1956г. ввел югославский ученый З.Рант и образован он из греческих корней «экс» - внешний и «эрг» - работа, действие.
Максимальную полезную работу (работоспособность) в
Уравнение состояния реального газа или уравнение Ван-дер-Ваальса
Одной из первых попыток в этой области была разработка голландского физика Н. Ван-дер-Ваальса в 1873 г. Это уравнение он получил на основе кинетической теории газов; учитывая объем самих молекул и
Гомогенные и гетерогенные термодинамические системы
Гомогенной называют такую систему, химический состав и физические свойства которой во всех ее частях одинаковы или изменяются непрерывно (без скачка) от одной точки системы к друго
Условия равновесия при фазовом переходе. Правило фаз Гиббса
Состояние равновесия – это такое состояние, к которому при данных внешних условиях стремится термодинамическая система.
Состояние устойчивого равновесия (стабильное состояние) характерно т
Парообразование и конденсация
Все газы явл. парами какого-либо вещества, поэтому принципиальной разницы между понятиями газ и пар нет. Водяной пар явл. реальным газом и широко используется в различных отраслях промышленности. Э
Основные параметры воды и водяного пара
Параметры состояния воды. Как указывалось ранее, удельный объём воды при 00С и различных давлениях одинаков и равен 0,001м3/кг,
При температурах насы
Основные термодинамические процессы водяного пара
В практике могут встретиться паровые процессы, которые протекают в области либо влажного насыщенного пара, либо в области перегретого пара, либо так, что одна часть процесса протекает в области вла
Изохорный процесс.
Изохоры на p,v –, T,S – и h,S – диаграммах представлены на рис. 12.1.
Изохорный процесс на р-v диаграмме (рис. 12.1.а) изображается отрезком вертикальной прямой 1-2, а на Т-S
Изобарный процесс.
На рис. 12.2. приведен изобарный процесс в p,v –, T,S – и h,S – диаграммах.
Как видно, на p,v – диаграмме (рис.12.2.а), изобара изображается горизонтальной прямой 1-2. В обла
Изотермический процесс.
Изотермический процесс в p,v – ; T,S – ; h,S – диаграмах изображен на рис. 12.3.:
Как видно в p,v – диаграмме (рис. 12.3а) изотерма в области влажного пара изображается отрез
Адиабатный процесс.
На рис. 12.4. приведен ади- абатный процесс в p,v – ; T,S – ; h,S – диаграмах.
Равновесный адиабатный процесс протека
Механическая связь сухого воздуха с водяным паром наз. влажным воздухом, или воздушно-паровой смесью.
Влажный воздух нужно рассматривать как разновидность газовой смеси. Это объясняется тем, что при атмосферном давлении в интервале температур, ограниченном снизу температурой обычно не ниже -50
Плотность, удельная газовая постоянная влажного воздуха.
Использовав обычное правило смеси, определим плотность влажного воздуха как сумму плотностей сухого воздуха
Теплоемкость и энтальпия влажного воздуха.
Изобарная теплоемкость влажного воздуха рассчитывается как сумма теплоемкостей 1 кг сухого воздуха и d кг водяного пара, т.е.:
Уравнение первого закона термодинамики для потока
До сих пор мы рассматривали только системы, вещество в которых не перемещалось (как целое) в пространстве; однако следует подчеркнуть, что первый закон ТТД имеет общий характер и сп
Сопла и диффузоры
Сопла и диффузоры – специально спрофилированные каналы, предназначенные для ускорения или торможения потока. Техническая работа в них не совершается, поэтому при условии горизонталь
Истечение из суживающегоcя сопла
Скорость газа на входе в сопло обозначим через c1. Будем считать, что давление газа на выходе из сопла p2 равно давлению среды, в которую вытекает газ.
Расход газа при истечении из суживающегося сопла
Массовый расход газа m через сопло, обычно выражаемый в кг/с, определяется из соотношения: , (15.1)
Удельны объем
Максимальный расход газа через суживающееся сопло
Максимальный расход газа при критическом значении можно определить из уравнения (15.3), если в него подставить значение из (15.4)
Критическая скорость истечения
Критическая скорость устанавливается в устье сопла при истечении в окружающую среду с давлением, равным или ниже критического. Ее можно определить из уравнения (15.6), подставив в него вместо значе
Анализ профиля канала сопла
Основой для вывода общих закономерностей движения рабочего тела в соплах и диффузорах явл. уравнение неразрывности потока
m = F c / v = const , (15.8)
Дросселирование газов и паров
Если в трубопроводе на пути движения газа или пара встречается местное сужение, то вследствие сопротивлений, возникаю
Дифференциальный дроссельный эффект
Изменение температуры жидкостей и реальных газов при адиабатном дросселировании впервые было установлено опытами ученых Джоуля и Томсона в 1852 г. и называется эффектом Джоуля-Томсона.
Опы
Устройство и принцип работы поршневых компрессоров
Конструктивная схема одноступенчатого компрессора показана на рис. 19.1
рис19.
Термодинамический анализ идеального компрессора
Идеализация компрессора и его работы заключается в следующем:
- Геометрический объем цилиндра компрессора равен рабочему объему (отсутствует вредное пространство);
- Отсутствует т
Влияние характера процесса сжатия на величину работы, затрачиваемой на привод компрессора
При конструировании компрессора необходимо организовать цикл компрессора так, чтобы:
a) Работа, затрачиваемая в цикле на сжатие газа от давления
Действительная (реальная) индикаторная диаграмма компрессора
Действительная индикаторная диаграмма компрессора отличается от теоретической тем, что вследствие сопротивления, оказываемого впускным и нагнетательным клапанами проходящему газу, всасывание происх
I, II, III - ступени сжатия; 1, 2 - промежуточные холодильники
Рабочий процесс в р,v - и Т,S - диаграммах (для идеального компрессора) представленный на рис. 20.3
Круговой процесс ДВС
Учитывая, что давление рабочего тела внутри двигателя порядка 3-10 Мпа, а температуры рабочего тела превышают критическую, рабочее тело можно рассматривать как идеальный газ.
По существу Д
Действительный и идеальный цикл с подводом теплоты при постоянном объеме. Цикл Отто
Индикаторные диаграммы цикла Отто представлены: действительная на рис. 21.3; идеальная p, v - диаграмма на рис. 21.4; T,S - диаграмма на рис. 21.5.
В качестве топлива в таких
Циклы ДВС с подводом теплоты при постоянном давлении. Цикл Дизеля
Степень сжатия e в цикле можно повысить, если сжимать не горючую смесь, а чистый воздух, а затем в конце процесса сжатия вводить в цилиндр жидкое топливо (горючее).
Циклы Д.В.С. со смешанным подводом теплоты. Цикл Тринклера
Недостатком двигателя Дизеля по сравнению с двигателем Отто является: наличие компрессора для распыления жидкого топлива, на работу которого расходуется 6-10% общей
мощности двигателя; сло
ЛЕКЦИЯ 23
23.1. Циклы реактивных двигателей
Реактивный двигатель представляет собой устройство, в котором химическая энергия топлива преобразуется в кинетическую
Циклы ПВРД
ПВРД - это ВРД, в которых сжатие воздуха осуществляется только за счет скоростного напора. ПВРД могут применяться как для дозвуковых, так и для сверхзвуковых полетов.
Основным параметром П
Циклы пульсирующего ВРД
В пульсирующих ВРД со сгоранием топлива при u=соnst применяются обратные клапаны, которые устанавливаются на клапанной решетке 2 (рис.23.4) на входе в камеру сгорания 5.
Клапаны клапанной
Циклы ракетных двигателей
В РД используются ядерная, электрическая, тепловая и химическая энергии.
В настоящее время в РД наиболее широко используется химическая энергия топлива,
Циклы газотурбинных установок (ГТУ)
ГТУ называются теплоэнергетические устройства, в которых рабочим телом служат газообразные продукты сгорания топлива (или другие газы, нагретые т
Реальные циклы ГТУ
Реальные циклы ГТУ отличаются от идеальных тем, что в действительных циклах учитываются неизбежные тепловые потери.
На рис. 25.5 показан реальный цикл ГТ
ЛЕКЦИЯ 26
26.1. Цикл ГТУ со сгоранием при р=const, с регенерацией теплоты и с иотермическим зжатием воздуха
Такой цикл изображен в Т,S диаграмме на рис.26.1при наличии регенерации т
Сравнение циклов ГТУ
Рис. 26.5
При равенстве ,
Паровой цикл Карно
Использование рабочего тела, изменяющего в течение цикла своё агрегатное состояние, позволяет осуществлять на практике цикл Карно.
В случае потока вещества технически наиболее просто осуще
Теоретический цикл ПТУ (цикл Ренкина)
Перечисленные выше недостатки, присущие паросиловой установке, в которой осуществляется цикл Карно на влажном паре, могут быть частично устранены, если отвод теплоты от влажного пара в конденсаторе
Цикл Ренкина с перегретым паром
Для того, чтобы увеличить термический к.п.д. цикла Ренкина, применяют так называемый перегрев пара в специальном элементе котла - пароперегревателе (рис.28.1), где пар нагревается д
А) Влияние начального давления пара
Анализируя цикл Ренкина рис. 28.3 для различных значений давления p1, при T1 = const и p2 = const, может сделать следующие выводы:
1. Чем выше давление p
Б) Влияние начальной температуры пара
Из рис. 28.4. видно, что η цикла Ренкина с ростом температуры перегрева пара при одном и том же давлении увеличивается, т.к. возрастает средняя температура подвода теплоты в цикле.
В) Влияние конечного давления в конденсаторе
При постоянных значениях начальных параметров пара T1 = const и p1 = сonst уменьшение конечного давления в конденсаторе приводит к повышению η цикла, т.к. в этом случае в
Цикл с промежуточным перегревом пара
Прежде всего следует заметить, что цикл Ренкина в чистом виде при высоких, а тем более сверхвысоких начальных параметрах пара (10МПа) осуществить невозможно по той причине, что влаж
Циклы холодильных установок и термотрансформаторов
Охлаждение тел до температуры ниже температуры окружающей среды и поддержание их в охлажденном состоянии в течение длительного времени составляют основную задачу холодильной техники. Для многих про
Цикл воздушной холодильной установки
Воздушная холодильная установка была одним из первых типов холодильных установок, применяемых на практике.
На рис. 29.1 приведена принципиальная схема воздушной холодильной машины (ВХМ).
Цикл парокомпрессорной холодильной установки
Более выгодны и удобны по сравнению с воздушными паровые компрессорные холодильные установки, позволяющие в области насыщенного пара осуществить изотермический отвод и подвод теплоты, отбираемой у
Абсорбционные холодильные машины
Основным преимуществом абсорбционных холодильных установок (АХУ) по сравнению с компрессорными явл. использование для выработки холода не электрической а тепловой энергии низкого и среднего потенци
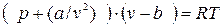 ,
,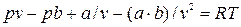
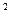 и разделив на р, получаем после приведения подобных членов:
и разделив на р, получаем после приведения подобных членов: 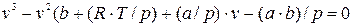 , (9.5)
, (9.5)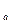 соответствует удельный объем v
соответствует удельный объем v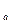 ). Это значение удельного объема и является действительным корнем уравнения (9.1), оба же мнимых корня в этом случае физического смысла не имеют и должны быть отброшены. Тело в этом случае при любых давлениях находится в газообразном состоянии. Это так наз. сверхкритические изотермы вандерваальского газа, т.е. изотермы при Т>T
). Это значение удельного объема и является действительным корнем уравнения (9.1), оба же мнимых корня в этом случае физического смысла не имеют и должны быть отброшены. Тело в этом случае при любых давлениях находится в газообразном состоянии. Это так наз. сверхкритические изотермы вандерваальского газа, т.е. изотермы при Т>T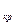 .
.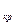 . На изотермах одному значению давления р соответствует три значения удельного объема (например, давлению р
. На изотермах одному значению давления р соответствует три значения удельного объема (например, давлению р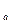 соответствуют удельные объемы v
соответствуют удельные объемы v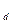 , v
, v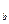 , v
, v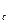 ), которые и являются тремя действительными и различными корнями уравнения (9.1). Участок 3-b соответствует изотермическому сжатию тела, находящегося в газообразном состоянии, причем в точке b оно уже начинает переходить в жидкое состояние. Точка d соответствует такому состоянию, когда оно уже полностью превратилось в жидкость, в соответствие с чем участок d-4 представляет собой изотермическое сжатие жидкости. Точка с соответствует промежуточному двухфазному состоянию тела. Участок кривой b-f соответствует неустойчивому состоянию переохлажденного пара, а участок d-e, также неустойчивому состоянию перегретой жидкости. Что же касается участка e-f, то он вообще физического смысла не имеет, поскольку в действительности при изотермическом сжатии тело переходит из газообразного в жидкое состояние при постоянном давлении, т.е. по горизонтальной линии b-d.
), которые и являются тремя действительными и различными корнями уравнения (9.1). Участок 3-b соответствует изотермическому сжатию тела, находящегося в газообразном состоянии, причем в точке b оно уже начинает переходить в жидкое состояние. Точка d соответствует такому состоянию, когда оно уже полностью превратилось в жидкость, в соответствие с чем участок d-4 представляет собой изотермическое сжатие жидкости. Точка с соответствует промежуточному двухфазному состоянию тела. Участок кривой b-f соответствует неустойчивому состоянию переохлажденного пара, а участок d-e, также неустойчивому состоянию перегретой жидкости. Что же касается участка e-f, то он вообще физического смысла не имеет, поскольку в действительности при изотермическом сжатии тело переходит из газообразного в жидкое состояние при постоянном давлении, т.е. по горизонтальной линии b-d.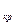 характерно наличие точки перегиба К , в которой удельные объемы v
характерно наличие точки перегиба К , в которой удельные объемы v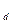 , v
, v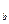 , v
, v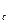 совпадают, т.е. три действительные корня равны.
совпадают, т.е. три действительные корня равны.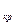 , v
, v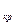 , Т
, Т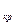 наз. критическими параметрами.
наз. критическими параметрами.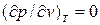
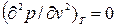 , (9.6)
, (9.6)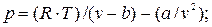
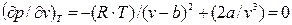 , (9.7)
, (9.7)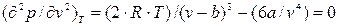 , (9.8)
, (9.8)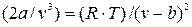 и
и 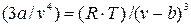
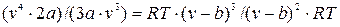 или 2v=3v-3b;
или 2v=3v-3b; =3b , (9.9)
=3b , (9.9)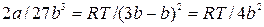
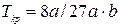 , (9.10)
, (9.10) и Т
и Т , получаем:
, получаем: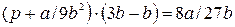
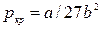 , (9.11)
, (9.11) Из рисунка видно, что кривые АВ, АК, АД делят р,Т – диагр. на три области: 1 – область жидкого состояния (вода), 2 – область парообразного состояния (пар), 3 – область твердого состояния – лед. Кривая АВ характеризует равновесное состояние жидкой и твердой фаз. Она определяет зависимость температуры плавления от давления и разделяет области твердого и жидкого состояний. Эта кривая наз. кривой плавления. Кривая АК представляет собой кривую кипения (конденсации), которая характеризует состояние жидкой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой кипения р=f (ts). Кривую кипения обычно называют кривой или линией насыщения. Линия АД, являющаяся кривой сублимации, характеризует равновесное состояние твердой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой возгонки и сублимации р=f (ts). Точки на этой кривой соответствуют двухфазной системе лед-пар. Точка А пересечения двух кривых фазового равновесия представляет собой тройную точку, в которой одновременно сосуществуют три фазы: вода, пар и лед. Вид кривых АВ, АК и АД и их расположение на р,Т – диагр. зависит от природы веществ. Для воды кривая плавления АВ, вследствие ее аномальных свойств, имеет наклон влево, т.е. с повышением давления температура плавления льда уменьшается.
Из рисунка видно, что кривые АВ, АК, АД делят р,Т – диагр. на три области: 1 – область жидкого состояния (вода), 2 – область парообразного состояния (пар), 3 – область твердого состояния – лед. Кривая АВ характеризует равновесное состояние жидкой и твердой фаз. Она определяет зависимость температуры плавления от давления и разделяет области твердого и жидкого состояний. Эта кривая наз. кривой плавления. Кривая АК представляет собой кривую кипения (конденсации), которая характеризует состояние жидкой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой кипения р=f (ts). Кривую кипения обычно называют кривой или линией насыщения. Линия АД, являющаяся кривой сублимации, характеризует равновесное состояние твердой и паровой фаз, т.е. зависимость между давлением насыщенного пара и температурой возгонки и сублимации р=f (ts). Точки на этой кривой соответствуют двухфазной системе лед-пар. Точка А пересечения двух кривых фазового равновесия представляет собой тройную точку, в которой одновременно сосуществуют три фазы: вода, пар и лед. Вид кривых АВ, АК и АД и их расположение на р,Т – диагр. зависит от природы веществ. Для воды кривая плавления АВ, вследствие ее аномальных свойств, имеет наклон влево, т.е. с повышением давления температура плавления льда уменьшается.







Новости и инфо для студентов