Условия равновесия при фазовом переходе. Правило фаз Гиббса
Состояние равновесия – это такое состояние, к которому при данных внешних условиях стремится термодинамическая система.
Состояние устойчивого равновесия (стабильное состояние) характерно тем, что если каким-либо внешним воздействием вывести из него рассматриваемую систему, а затем снять это внешнее воздействие, то система сама возвратится в исходное состояние равновесия.
Если систему, находящуюся в состоянии неустойчивого равновесия (лабильное равновесие) из него вывести, то она уже не возвратится в исходное состояние, я перейдет в состояние устойчивого равновесия. Даже очень малые внешние воздействия выводят систему из лабильного состояния.
Состояние относительно устойчивого равновесия (метастабильное состояние) – это состояние, в котором система может находится в течение длительного времени, причем слабые внешние возмущения, вызывающие отклонения системы от метастабильного состояния, не приводят к переходу в другое состояние; после того, как такое внешнее воздействие снято, система возвратится в исходное метастабильное состояние.
Рассмотрим изолированную систему, состоящую из двух или более фаз. Установим для такой системы общие условия фазового равновесия.
Предположим, что система состоит из двух подсистем 1 и 2, например, сосуд постоянного объема V с идеально теплоизолированными стенками, учтем, что вещество в подсистемах находится в двух разных фазах, например, в нижней части сосуда находится вода, а верхней – водяной пар. Причем количество вещества в подсистемах может меняться вследствие перехода из одной фазы в другую.
Такую систему, учитывая, что Vсис=const, m=const, U=const, можно представить себе, записав для нее следующие выражения:
V=V1+V2; (10.1) m=m1+m2; (10.2) U=U1+U2, (10.3)
где индексы 1 и 2 относятся соответственно к 1-ой и 2-ой фазам. Т.к. система изолирована, то получается: dV1= - dV2; (10.4)
dm1= - dm2, (10.5) dU1= - dU2, (10.6)
При состоянии термодинамического равновесия энтропия изолированной системы сохраняет постоянное (максимальное значение), т.е. в состоянии равновесия: dS=0, (10.7)
Поскольку энтропия явл. аддитивной величиной, применительно к рассматриваемому случаю: S=S1+S2 , (10.8).
И, следовательно: dS=dS1+dS2=0 , (10.9)
Найдем выражение для полного дифференциала энтропии подсистемы 1. В рассмат- риваемой подсистеме S1 явл. функцией не только V1 и U1, но и m1, т.е.: S1=f (V1, U1, m1).
В соответствие с этим:
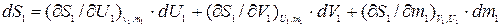 , (10.10)
, (10.10)
Как известно: 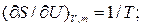
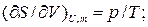
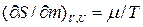
Где 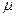 - химический потенциал или изобарно-изотермический потенциал (он позволяет рассчитать изменение характеристической функции любой системы при изменении количества вещества в системе):
- химический потенциал или изобарно-изотермический потенциал (он позволяет рассчитать изменение характеристической функции любой системы при изменении количества вещества в системе): 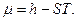
С учетом этих соотношений выражение (10.10) приобретает следующий вид:
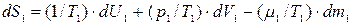 (10.11)
(10.11)
Аналогично находим полный дифференциал энтропии подсистемы 2:

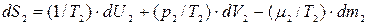 , (10.12)
, (10.12)
Из выражений (10.9), (10.11) и (10.12) с учетом соотношений (10.4) – (10.6) имеем:
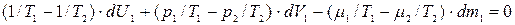 , (10.13)
, (10.13)
Поскольку дифференциал dV1, dU1, dm1 взаимно независимы, то для выполнения (10.13) необходимо, чтобы были равны нулю сомножители при дифференциалах dV1, dU1, dm1, т.е. чтобы:
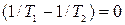 , (10.14)
, (10.14) 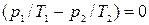 , (10.15)
, (10.15) 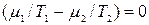 , (10.16)
, (10.16)
Откуда получаем следующие условия: T1=T2 , (10.17); р1=р2 , (10.18); 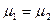 , (10.19)
, (10.19)
Таким образом, если две фазы находятся в равновесии, то температуры, давления и химические потенциалы этих фаз равны между собой. Равенство химических потенциалов фаз означает, что в условиях равновесия удельные энергии в фазах равны.
Из условий равновесия (10.17) – (10.19) следует, что если в системе, состоящей из нескольких фаз, будет наблюдаться равновесное состояние, то они не дают возможности заключить, сколько фаз могут находиться между собой в равновесии. Ответ на этот вопрос дает правило фаз Гиббса. Правило фаз, установленное Гиббсом, определяет зависимость между числом независимых параметров системы в состоянии равновесия, числом фаз и числом компонентов системы. Это правило записывается в виде: N = n – φ + 2, (10.20)
где N – число независимых параметров (переменных) системы, n – число компонентов системы, 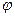 - число фаз в системе.
- число фаз в системе.
Величина N наз. также числом термодинамических степеней свободы системы. Она показывает, какое число параметров системы, находящейся в состоянии равновесия, можно изменить произвольно, не изменяя при этом числа фаз в системе. Очевидно, величина N всегда положительна, причем она может быть равной нулю, т.е. N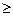 0. Для однокомпонентной системы, состоящей из одной фазы, находим N=2. Это означает, что состояние простых однородных систем (идеальный газ, однородная жидкость) определяется двумя независимыми параметрами. Для многокомпонентных систем число степеней свободы может быть больше двух, и для определения состояния, кроме двух термодинамических параметров необходимо знать концентрации компонентов. Из уравнения (10.20) видно, что с увеличением числа фаз в системе, N – уменьшается, т.е. число свободно варьируемых параметров убывает. Правило фаз выполняется для всех возможных систем, не смотря на проходящие в них фазовые превращения и химические реакции, оно справедливо для веществ в любых агрегатных состояниях.
0. Для однокомпонентной системы, состоящей из одной фазы, находим N=2. Это означает, что состояние простых однородных систем (идеальный газ, однородная жидкость) определяется двумя независимыми параметрами. Для многокомпонентных систем число степеней свободы может быть больше двух, и для определения состояния, кроме двух термодинамических параметров необходимо знать концентрации компонентов. Из уравнения (10.20) видно, что с увеличением числа фаз в системе, N – уменьшается, т.е. число свободно варьируемых параметров убывает. Правило фаз выполняется для всех возможных систем, не смотря на проходящие в них фазовые превращения и химические реакции, оно справедливо для веществ в любых агрегатных состояниях.
В условиях равновесия термодинамической системы правило фаз Гиббса записывается в виде: 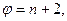 (10.21)
(10.21)