рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Физика
- /
- Спектр атома водорода. Правило отбора.
Реферат Курсовая Конспект
Спектр атома водорода. Правило отбора.
Спектр атома водорода. Правило отбора. - раздел Физика, Квантовая оптика. Квантовая физика A)Полосатые Спектры Характерны Для… B) Линейчатые С...
| A)Полосатые спектры характерны для… B) Линейчатые спектры характерны для… | атомарных газов жидкостей твердых тел молекулярных газов | ||||||||
| Выберите верные утверждения: | 1. состояние электрона в атоме характеризуется тремя квантовыми числами;
2. принцип Паули справедлив только для фермионов;
3. магнитное спиновое квантовое число может иметь только два значения 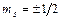 . .
| ||||||||
| Выберите верные утверждения: | 1. инверсная населенность – это такое заполнение электронами энергетических уровней, при котором нарушается принцип Паули; 2. инверсная населенность – это состояние, при котором возбужденных атомов в веществе больше, чем невозбужденных; 3. когерентность лазерного излучения обусловлена индуцированными переходами. 4. когерентность лазерного излучения обусловлена спонтанными переходами. | ||||||||
При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). В энергетическом спектре атома водорода запрещенным переходом является...
A)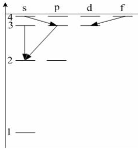 B) B) C)
C) 
| A) 3s-2s 3p-2s 4f-3d 4s-3р B) 3s-2s 3d-2p 3s-2p 4s-3p C) 4s-3р 2р-1s 3d-2p 4d-2s | ||||||||
На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой - серию Бальмера, в инфракрасной - серию Пашена.
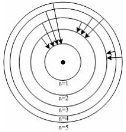 Наибольшей частоте кванта в серии Лаймана соответствует переход...
Наибольшей частоте кванта в серии Лаймана соответствует переход...
| n = 2 → n = 1 n = 5 → n = 3 n = 3 → n = 2 n = 5 → n = 1 | ||||||||
На рисунке дана схема энергетических уровней атома водорода, а также условно изображены переходы электрона с одного уровня на другой, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой области – серию Бальмера, в инфракрасной области – серию Пашена и т.д. 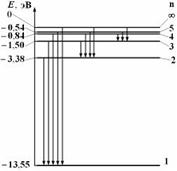 Отношение максимальной частоты линии в серии Пашена Отношение максимальной частоты линии в серии Пашена 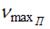 к минимальной частоте линии в серии Бальмера к минимальной частоте линии в серии Бальмера 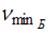 равно … равно …
|
| ||||||||
Собственные функции электрона в атоме водорода 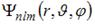 содержат три целочисленных параметра: n, l и m. Параметр n называется главным квантовым числом, параметры l и m – орбитальным (азимутальным) и магнитным квантовыми числами соответственно. Орбитальное квантовое число l определяет содержат три целочисленных параметра: n, l и m. Параметр n называется главным квантовым числом, параметры l и m – орбитальным (азимутальным) и магнитным квантовыми числами соответственно. Орбитальное квантовое число l определяет
|
| ||||||||
На рисунке дана схема энергетических уровней атома водорода.  Наибольшая длина волны спектральной линии (в нм) серии Лаймана равна …(h = 6,63·10-34 Дж·с) Наибольшая длина волны спектральной линии (в нм) серии Лаймана равна …(h = 6,63·10-34 Дж·с)
|
| ||||||||
На рисунке схематически изображены стационарные орбиты электрона в атоме водорода согласно модели Бора, а также показаны переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. 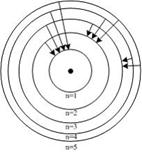 Наибольшей частоте кванта в серии Пашена (для переходов, представленных на рисунке) соответствует переход … Наибольшей частоте кванта в серии Пашена (для переходов, представленных на рисунке) соответствует переход …
|
| ||||||||
На рисунке изображена схема энергетических уровней атома водорода. Показаны состояния с различными значениями орбитального квантового числа. Запрещенными правилом отбора для орбитального квантового числа являются переходы…
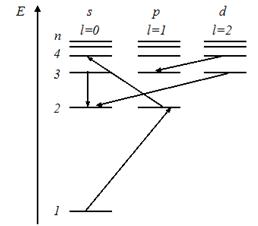
| 
| ||||||||
Собственные функции электрона в атоме водорода 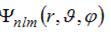 содержат три целочисленных параметра n, l и m. Параметр n называется главным квантовым числом, параметры l и m – орбитальным и магнитным квантовыми числами соответственно. Магнитное квантовое число m определяет… содержат три целочисленных параметра n, l и m. Параметр n называется главным квантовым числом, параметры l и m – орбитальным и магнитным квантовыми числами соответственно. Магнитное квантовое число m определяет…
| 1.модуль орбитального момента импульса электрона 2.проекцию орбитального момента импульса электрона на некоторое направление 3.модуль собственного момента импульса электрона 4.энергию электрона в атоме водорода | ||||||||
На рисунке дана схема энергетических уровней атома водорода, а также условно изображены переходы электрона с одного уровня на другой, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой области – серию Бальмера, в инфракрасной области – серию Пашена и т. д. Отношение минимальной частоты серии Лаймана к максимальной частоте серии Бальмера равно…
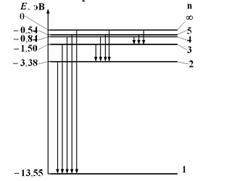
| 5,4 7,2 | ||||||||
На рисунке изображена схема энергетических уровней атома водорода. Показаны состояния с различными значениями орбитального квантового числа. Серию Бальмера дают переходы…
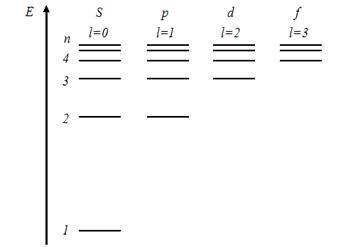
| 
| ||||||||
– Конец работы –
Эта тема принадлежит разделу:
Квантовая оптика. Квантовая физика
На сайте allrefs.net читайте: Квантовая оптика. Квантовая физика.
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Спектр атома водорода. Правило отбора.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?

Подпишитесь на Нашу рассылку
Наша политика приватности обеспечивает 100% безопасность и анонимность Ваших E-Mail

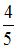
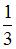
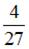
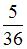
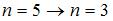

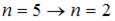






Новости и инфо для студентов