Уравнение состояния идеального газа
Зависимость между параметрами идеального газа p, V, T была установлена Б. Клапейроном в 1834 г.
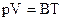 , (14)
, (14)
где В – коэффициент, зависящий от массы газа и его молярной массы.
В 1874 г. Д.И. Менделеев вывел уравнение состояния для 1 моля идеального газа
 , (15)
, (15)
где R = 8,31 Дж/(моль.К) – универсальная газовая постоянная.
 , (16)
, (16)
где p0, V0, T0 – параметры газа при нормальных условиях (105 Па, 22,4.10-3 м3, 273 К).
Для произвольного количества молей n уравнение (15) переходит в уравнения (17.1), (17.2), (17.3), называемые уравнением состояния идеального газа
 , (17.1)
, (17.1)
 (17.2)
(17.2)
или 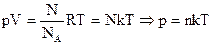 (17.3)
(17.3)
где - постоянная Больцмана.
- постоянная Больцмана.
Уравнение состояния идеального газа (любое из (17.1)-(17.3)), оно же уравнение Клапейрона-Менделеева, объединяет известные законы Бойля-Мариотта, Гей-Люссака, Шарля, Авогадро.
Уравнение состояния идеального газа – наиболее простое уравнение, применимое с определенной степенью точности к реальным газам. При низких давлениях и высоких температурах все газы удовлетворяют понятию «идеальный» и почти все газы при температурах, далеких от точки конденсации данного газа, и давлениях, не очень сильно превышающих атмосферное.