Реальные газы. Уравнение Ван-дер-Ваальса
Газ является идеальным при небольших плотностях. Когда плотность возрастает, молекулы приближаются друг к другу, между ними возникает взаимодействие. Опыт показывает, что при этом уравнение Клапейрона - Менделеева точно не выполняется.
Чтобы найти уравнение состояния реального газа, нужно определить, как взаимодействие молекул влияет на давление. Рассмотрим взаимодействие двух молекул (рисунок 11).
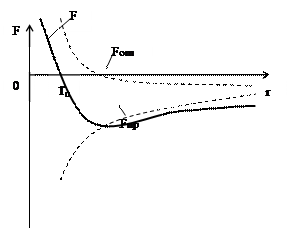 Из рисунка видно, что при r > r0 взаимная потенциальная энергия отрицательна, так как F < 0, между молекулами существует лишь сила притяжения. При r = r0 сила равна нулю F(r0) = 0, то есть энергия минимальна. Если r < r0, то между молекулами существенна лишь сила отталкивания.
Из рисунка видно, что при r > r0 взаимная потенциальная энергия отрицательна, так как F < 0, между молекулами существует лишь сила притяжения. При r = r0 сила равна нулю F(r0) = 0, то есть энергия минимальна. Если r < r0, то между молекулами существенна лишь сила отталкивания.
Fоm – силы отталкивания;
Fпр – силы притяжения;
 - результирующая сила.
- результирующая сила.
Следовательно, в формулу 
нужно внести поправки, которые
учитывали бы случаи r > r0 и r < r0.
Учтем силу притяжения, которая Рисунок 11
обратно пропорциональна седьмой степени расстояния между молекулами  ~
~  . Потенциальная энергия притяжения составляет Е = (0,4¸4) кДж/моль.
. Потенциальная энергия притяжения составляет Е = (0,4¸4) кДж/моль.
 Силы притяжения уменьшают силу давления молекул на стенку. Так как р ~ n, следовательно, на каждую из N молекул в объеме V действует сила притяжения F, тогда поправка к давлению
Силы притяжения уменьшают силу давления молекул на стенку. Так как р ~ n, следовательно, на каждую из N молекул в объеме V действует сила притяжения F, тогда поправка к давлению  ~ Fn. Сила притяжения заметно действует на расстоянии некоторого r, следовательно ее величина пропорциональна числу молекул в полусфере радиуса r (рисунок 6) F ~ n.
~ Fn. Сила притяжения заметно действует на расстоянии некоторого r, следовательно ее величина пропорциональна числу молекул в полусфере радиуса r (рисунок 6) F ~ n.
Тогда  , где
, где  - постоянная величина для данного газа в данных условиях. С учетом этой по правки
- постоянная величина для данного газа в данных условиях. С учетом этой по правки  . (41)
. (41)
При r < r0 возникают силы отталкивания:  ~
~  , где n ³ 9, которые и увеличивают давление. Энергия отталкивания составляет Рисунок 12 (4¸40) кДж/моль, то есть Еот~ 10Епр.
, где n ³ 9, которые и увеличивают давление. Энергия отталкивания составляет Рисунок 12 (4¸40) кДж/моль, то есть Еот~ 10Епр.
Если объем одной молекулы равен  , то объем всех молекул N
, то объем всех молекул N . Учитывая эту поправку к объему, формула запишется
. Учитывая эту поправку к объему, формула запишется
 . (42)
. (42)
В таком виде учитываются поправки на силы притяжения и отталкивания молекул. При V >  сказываются в основном силы притяжения, при V ~
сказываются в основном силы притяжения, при V ~  cказываются силы отталкивания. Учитывая, что
cказываются силы отталкивания. Учитывая, что  , формула (42) примет вид
, формула (42) примет вид
 . (43)
. (43)
Чаще всего уравнение (43) записывают через число молей n, выражая N = f(n), N = nNA.
 , или
, или  , (44)
, (44)
где  - поправка на давление,
- поправка на давление,
 - поправка на объем, равная собственному объему молекул моля вещества.
- поправка на объем, равная собственному объему молекул моля вещества.
Уравнение (44) называется уравнением Ван-дер-Ваальса по имени голландского ученого, который сумел найти связь между параметрами реального газа. Коэффициенты a и b получены опытным путем и могут быть найдены из таблиц поправок для газов.
В 1866 г. Т. Эндрюс экспериментально исследовал зависимость молярного объема углекислого газа от давления при изотермическом сжатии.
При Т < Ткр = 340 К на каждой изотерме имеется горизонтальный участок, вдоль которого постоянна не только температура, но и давление. На критической изотерме (Т=Ткр) есть лишь перегиб. Заштрихованные участки соответствуют жидкости, влажному пару (жидкость-пар), газу.