рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Механика
- /
- Основы термодинамики
Реферат Курсовая Конспект
Основы термодинамики
Основы термодинамики - раздел Механика, Федеральное агенТство по образованию Первое Начало Термодинамики – Это Закон Сохранения И Превращ...
Первое начало термодинамики – это закон сохранения и превращения энергии, которым сопровождаются термодинамические процессы. Оно утверждает: «Изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме механических эквивалентов всех внешних воздействий».
Математически первое начало термодинамики можно записать так:
dU = dQ – dA + dM,
где dU – изменение внутренней энергии системы;
dQ – элементарное количество тепла, подводимого к системе;
dA – элементарная работа, совершаемая системой;
dM – другие виды элементарных энергий.
Если dM = 0, то
dU = dQ – dA или dQ = dU + dA.
Изотермический процесс – процесс, протекающий при постоянной температуре (T = const).
Первое начало термодинамики для изотермического процесса: так как
dU = CVdT = 0, то U = const, а dQ = dU + dA = dA,
т.е. все подводимое к системе тепло идет на совершение этой системой работы.
Работа, совершаемая идеальным газом при изотермическом процессе:
а) для моля или киломоля идеального газа:
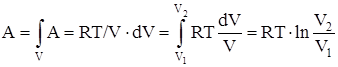 ,
,
или
 ;
;
б) для произвольной массы газа:
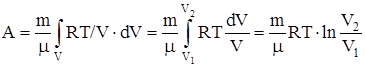 ,
,
или
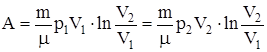 .
.
Изобарический процесс – процесс, протекающий при постоянном давлении (p = const).
Первое начало термодинамики для изобарического процесса:
dQp = dU + dA,
т.е. подводимое к системе тепло идет как на изменение ее внутренней энергии, так и на совершение этой системой работы. При этом:
а) для моля или киломоля идеального газа:
dQp = CpdT, dU = CVdT, dA = pdV = RdT;
б) для произвольной массы газа:
dQp = mCpdT/μ, dU = mCVdT/μ, dA = mpdV/μ = mRdT/μ.
Доля подводимой к системе энергии, которая идет на совершение работы:
dA = R/Cp×dQp = (1 – 1/g) dQp = dQp×(g – 1)/g.
Доля подводимой к системе энергии, которая идет на изменение внутренней энергии системы:
а) для моля или киломоля идеального газа:
dU = CVdT = dQp CV/Cp = dQp/g;
б) для произвольной массы газа:
dU = mCV×dT/μ = m×dQpCV/μCp = mdQp/μg,
где g = Cp/CV.
Изохорический процесс – процесс, протекающий при постоянном объеме (V = const).
Первое начало термодинамики для изохорического процесса:
Так как dA = p×dV = 0,
то dQV = dU + dA = dU,
т.е. при изохорическом процессе все подводимое к системе тепло идет на изменение ее внутренней энергии. При этом
dQV = CVdT,
следовательно,
dU = CVdT, или DU = CvDT.
Изменение внутренней энергии системы пропорционально изменению ее температуры.
Адиабатические или адиабатные процессы –процессы, протекающие без теплообмена или почти без теплообмена с окружающей средой. Примером адиабатического процесса может служить быстро протекающий процесс сжатия или расширения газа.
Первое начало термодинамики для адиабатического процесса: так как dQ = 0, то
dU + dA = 0, a dA = –dU,
т.е. работа, совершаемая системой при адиабатическом процессе, сопровождается уменьшением ее внутренней энергии.
Связь между параметрами состояния системы при адиатическом процессе (уравнения Пуассона):

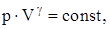
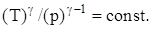
Работа, совершаемая произвольной массой m идеального газа при адиабатическом расширении:
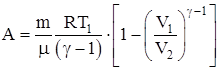 .
.
Политропическим называют процесс, при котором p и V связаны следующими соотношениями:
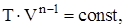
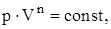

где n – показатель политропы, принимающий любые значения от –¥ до +¥.
Работа, совершаемая идеальным газом при политропическом процессе:

Обратимый процесс– это процесс, который протекает так, что после его окончания систему можно вернуть в первоначальное состояние, причем никаких изменений в окружающей систему среде не произойдет.
Необратимый процесс– это процесс, протекающий так, что после его окончания систему нельзя вернуть в первоначальное состояние без изменений в окружающей среде.
Круговой процесс (цикл) – это такая последовательность превращений, в результате которой система, выйдя из какого-либо исходного состояния, возвращается в него вновь.
Любой круговой процесс состоит из процессов расширения и сжатия. Процесс расширения сопровождается работой, совершаемой системой, а процесс сжатия – работой, совершаемой над системой внешними силами. Разность этих работ равна работе данного цикла.
Если работа при расширении больше, чем работа при сжатии, то такой процесс (цикл) называется прямым. В противном случае – обратным.
Коэффициент полезного действия при круговых процессах (характеристика эффективности цикла) – физическая величина, равная отношению работы цикла к работе, которую можно было бы совершить при превращении в нее всего количества тепла, подведенного к системе:
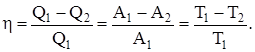
Цикл Карно состоит из двух изотермических и двух адиабатических процессов.
Коэффициент полезного действия цикла Карно (КПД)
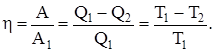
КПД цикла Карно не зависит от природы вещества, а зависит лишь от температур, при которых теплота сообщается системе и отбирается от нее.
Коэффициент полезного действия холодильной машины (холодильника)
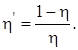
Примечание. Кроме цикла Карно в технической термодинамике применяются цикл Отто, состоящий из двух адиабатических и двух изохорических процессов, и цикл Дизеля, состоящий из двух адиабатических, изохорического и изобарического процессов.
Энтропия – физическая величина, элементарное изменение которой при переходе системы из одного состояния в другое равно полученному или отданному количеству теплоты, деленному на температуру, при которой произошел этот процесс:
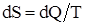 .
.
Связь энтропии системы с термодинамической вероятностью (соотношение Больцмана):
S = k×lnw,
где k – постоянная Больцмана.
Изменение энтропии системы при переходе из одного состояния в другое:
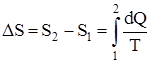 ,
,
или
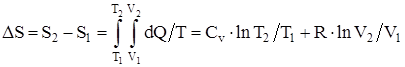 .
.
Изменение энтропии системы при изотермическом процессе:
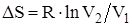 .
.
Изменение энтропии системы при изобарическом процессе:
 .
.
Изменение энтропии системы при изохорическом процессе:
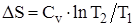 .
.
Изменение энтропии системы при адиабатическом процессе:
DS = 0, 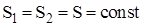 .
.
Изменение энтропии системы, совершающей цикл Карно:
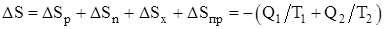 ,
,
где DSр – изменение энтропии рабочего тела;
DSн, DSх – изменение энтропии нагревателя и холодильника;
DSпр – изменение энтропии «потребителя работы».
В случае совершения системой обратимого цикла Карно энтропия замкнутой системы не изменяется:
DSобр = 0, или Sобр = const.
В случае совершения системой необратимого цикла Карно энтропия замкнутой системы возрастает:
DS > 0;  ;
; 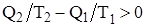 .
.
Для произвольных процессов, происходящих в замкнутой системе, энтропия системы для любых, происходящих в ней процессах, не может убывать:
DS ³ 0 или 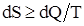 ,
,
где знак «равенства» справедлив для обратимых процессов, а знак «неравенства» – для необратимых.
Второе начало термодинамики: «В изолированной системе возможны только такие процессы, при которых энтропия системы возрастает или невозможен процесс, единственным результатом которого является превращение в работу теплоты, полученной от нагревателя»:
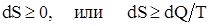 .
.
Термодинамические потенциалы – определенные функции объема V, давления p, температуры T, энтропии S, числа частиц системы N и других макроскопических параметров x, характеризующих состояние термодинамической системы:
а) внутренняя энергия – энергия системы, зависящая от ее внутреннего состояния. Она является однозначной функцией независимых переменных, определяющих это состояние, например температуры T и объема V (или давления p):
U = U (S, V, N, x).
Изменение внутренней энергии системы DU определяется лишь ее значениями в начальном и конечном состояниях:
 ;
;
б) энтальпия (теплосодержание) характеризует состояние макроскопической системы в термодинамическом равновесии при выборе в качестве основных независимых переменных энтропии S и давления p:
H = H (S, p, N, x).
Энтальпия системы равна сумме энтальпий составляющих ее частей.
Связь энтальпии с внутренней энергией U системы:
 ,
,
где V – объем системы.
– Конец работы –
Эта тема принадлежит разделу:
Федеральное агенТство по образованию
Государственное образовательное учреждение... высшего профессионального образования... Курский государственный технический университет...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Основы термодинамики
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов