Энергия упругой волны
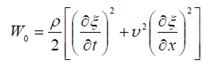
вектор плотности потока энергии физического поля; численно равен энергии, переносимой в единицу времени через единичную площадку, перпендикулярную направлению потока энергии в данной точке.
27. Сложение (интерференция) волн. Стоячие волны.
Интерференция волн - сложение в пространстве двух (или нескольких) волн, в результате чего происходит ослабление или усиление амплитуды результирующей волны. Интерференция волн возникает при наличии когерентности (определённой корреляции фаз) налагающихся волн. Интерференция характерна для волн любой природы и частоты.
Интерференция волн — наложение волн, при котором происходит их взаимное усиление в одних точках пространства и ослабление – в других. Результат интерференции зависит от разности фаз накладывающихся волн.
Интерферировать могут только волны, имеющие одинаковую частоту, в которых колебания совершаются вдоль одного и того же направления (т. е. когерентные волны). Интерференция бывает стационарной и нестационарной. Стационарную интерференционную картину могут давать только когерентные волны (Волны и возбуждающие их источники называются когерентными, если разность фаз волн 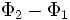 не зависит от времени.) Например, две сферические волны на поверхности воды, распространяющиеся от двух когерентных точечных источников, при интерференции дадут результирующую волну. Фронтом результирующей волны будет сфера.
не зависит от времени.) Например, две сферические волны на поверхности воды, распространяющиеся от двух когерентных точечных источников, при интерференции дадут результирующую волну. Фронтом результирующей волны будет сфера.
При интерференции волн не происходит сложения их энергий. Интерференция волн приводит к перераспределению энергии колебаний между различными близко расположенными частицами среды. Это не противоречит закону сохранения энергии потому, что в среднем, для большой области пространства, энергия результирующей волны равна сумме энергий интерферирующих волн.
Очень важный случай интерференции наблюдается при наложении двух встречных плоских волн с одинаковой амплитудой. Возникающий в результате колебательный процесс называется стоячей волной. Практически стоячие волны возникают при отражении от преград. В стоячей волне не происходит течения энергии. Такие волны возникают, например, в упругой системе — стержне или столбе воздуха, находящегося внутри трубы, закрытой с одного конца, при колебаниях поршня в трубе
Напишем уравнения двух плоских волн, распространяющихся в противоположных направлениях (начальная фаза 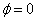 )
)
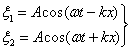
Сложим уравнения и преобразуем по формуле суммы косинусов
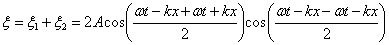
Т.к. 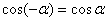 , то можно записать:
, то можно записать: 
Учитывая, что 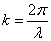 , получим уравнение стоячей волны:
, получим уравнение стоячей волны: 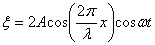
В выражении для фазы не входит координата, поэтому можно записать:  ,
,
где суммарная амплитуда 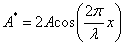 /
/
В точках, где координаты удовлетворяют условию 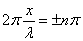 , (n = 1, 2, 3, …),
, (n = 1, 2, 3, …), 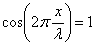 , суммарная амплитуда равна максимальному значению
, суммарная амплитуда равна максимальному значению 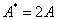 это пучности стоячей волны. Координаты пучностей:
это пучности стоячей волны. Координаты пучностей: 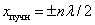 .
.
В точках, координаты которых удовлетворяют условию  (n = 0, 1, 2,…),
(n = 0, 1, 2,…), 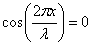 и суммарная амплитуда колебаний равна нулю
и суммарная амплитуда колебаний равна нулю  то узлы стоячей волны. Координаты узлов:
то узлы стоячей волны. Координаты узлов:  .
.
Точки среды, находящиеся в узлах, колебаний не совершают.
Образование стоячих волн наблюдают при интерференции бегущей и отраженных волн. На границе, где происходит отражение волны, получается пучность, если среда, от которой происходит отражение, менее плотная, и узел – если более плотная.
28. Термодинамическая система параметры состояния термодинамической системы. Основные положения молекулярно-кинетической теории газов.
Термодинамическая система — это любая область пространства, ограниченная действительными или воображаемыми границами, выбранными для анализа её внутренних термодинамических параметров.
Пространство, смежное с границей системы, называется внешней средой. У всех термодинамических систем есть среда, с которой может происходить обмен энергии и вещества.
Границы термодинамической системы могут быть неподвижными или подвижными.
Системы могут быть большими или маленькими, в зависимости от границ.
Система может существовать в вакууме или может содержать несколько фаз одного или более веществ. Термодинамические системы могут содержать сухой воздух и водяной пар (два вещества) или воду и водяной пар (две стадии одного и того же вещества). Однородная система состоит из одного вещества, одной его фазы или однородной смеси нескольких компонентов.
Системы бывают изолированными (замкнутыми) или открытыми. В изолированной системе не происходит никаких обменных процессов с внешней средой. В открытой системе и энергия и вещество могут переходить из системы в среду и обратно.
Состояние термодинамической системы определяется физическими свойствами вещества. Температура, давление, объем, внутренняя энергия, энтальпия и энтропия — это термодинамические величины, определяющие те или иные интегральные параметры системы. Данные параметры строго определяются лишь для систем, находящихся в состоянии термодинамического равновесия.
Различают экстенсивные параметры состояния, пропорциональные массе термодинамической системы, и интенсивные параметры состояния, не зависящие от массы системы. К экстенсивным параметрам состояния. относятся: объём, Внутренняя энергия, Энтропия, Энтальпия, изохорно-изотермический потенциал Гиббсова энергия), изобарно-изометрический потенциал (Гельмгольцева энергия); к интенсивным параметрам состояния— давление, температура, концентрация, магнитная индукция и др. параметры состояния взаимосвязаны, так что равновесное состояние системы можно однозначно определить, установив значения ограниченного числа параметров состояния.
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу.
29. Закон равномерного распределения энергии по степеням свободы молекул. Основное уравнение молекулярно-кинетической теории газов.
Число степеней свободы – это число независимых величин с помощью которых может быть задано положение системы. (1 атом =3 ст., 2 атома =5ст. 3 атома=6ст.)
Закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная КТ/2 , а на каждую колебательную – КТ
средняя энергия приходящаяся на одну степень свободы:
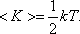
У одноатомной молекулы i = 3, тогда для одноатомных молекул:
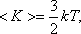
для двухатомных молекул:
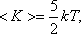
Таким образом, на среднюю кинетическую энергию молекулы, имеющей i-степеней свободы, приходится:
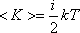
Молекулярно-кинетическая теория (сокращённо МКТ) — теория, рассматривающая строение вещества с точки зрения трёх основных приближенно верных положений:
1) все тела состоят из частиц, размером которых можно пренебречь: атомов, молекул и ионов;
2) частицы находятся в непрерывном хаотическом движении (тепловом);
3) частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Основное уравнение молекулярно-кинетической теории идеального газа:
Уравнение, связывающее макроскопическую величину – давление с микроскопическими величинами, характеризующими молекулы.
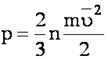
p – давление газа, n - концентрация молекул, m0 - масса молекулы.
30. Уравнение состояния идеального газа.

Французский физик и инженер Б. Клапейрон (1799—1864) вывел уравнение состояния идеального газа, объединив законы Бойля — Мариотта и Гей-Люссака. Пусть некоторая масса газа занимает объем V1, имеет давление р1 и находится при температуре Т1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами р2, V2, Т2 (рис.63). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов: 1) изотермического (изотерма 1—1'), 2) изохорного (изохора 1'—2).
В соответствии с законами Бойля — Мариотта pV = const (при Т=const, m=const) и Гей-Люссака р1/р2 = T1/T2 (при V=const, m=const) запишем:
p1V1=p'1V2, (42.1)
p'1/p'2=T1/T2 . (42.2)
Исключив из уравнений (42.1) и (42.2) р'1, получим
p1V1/T1=p2V2/Т2 .
Так как состояния 1 и 2 были выбраны произвольно, то для данной массы газа
величина pV/T остается постоянной, т. е.
pV/T =B=const. (42.3)
Выражение (42.3) является уравнением Клапейрона,в котором В — газовая постоянная, различная для разных газов.
Русский ученый Д. И. Менделеев (1834—1907) объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (42.3) к одному молю, использовав молярный объем Vт. Согласно закону Авогадро, при одинаковых р и Т моли всех газов занимают одинаковый молярный объем Vm, поэтому постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и называется молярной газовой постоянной.Уравнению
pVm = RT (42.4)
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа,называемым также уравнением Клапейрона — Менделеева.
Числовое значение молярной газовой постоянной определим из формулы (42.4), полагая, что моль газа находится при нормальных условиях (р0=1,013•105 Па, T0=273,15 K:, Vm= 22,41•10-3м3/моль): R = 8,31 Дж/(моль•К).
От уравнения (42.4) для моля газа можно перейти к уравнению Клапейрона — Менделеева для произвольной массы газа. Если при некоторых заданных давлений и температуре один моль газа занимает молярный объем l/m, то при тех же условиях масса т газа займет объем V = (m/M) Vm, где М — молярная масса(масса одного моля вещества). Единица молярной массы — килограмм на моль (кг/моль). Уравнение Клапейрона — Менделеева для массы т газа
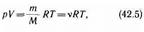
где v = m/M — количество вещества.
Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана:
k=R/NА=1,38•10-23 Дж/К.
Исходя из этого уравнение состояния (42.4) запишем в виде
p = RT/Vm = kNAT/Vm = nkT,
где NA/Vm = n—концентрация молекул (число молекул в единице объема).
31. Закон Максвелла распределения молекул по скоростям теплового движения. Барометрическая формула. Распределение Больцмана.