Закон Максвелла распределения молекул по скоростям теплового движения
Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на
малые интервалы, равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул dN (v)/N, скорости которых лежат в интервале от v до v+dv, т. е.
откуда f(v)=dN(v)/Ndv.
Применяя методы теории вероятностей, Максвелл нашел функцию f(v) — закон для распределения молекул идеального газа по скоростям:
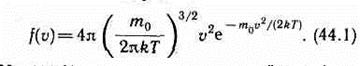
Из (44.1) видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т).График функции (44.1) приведен на рис. Так как при возрастании v множитель уменьшается быстрее, чем растет множитель v2, то функция f(v), начинаясь от нуля, достигает максимума при vв и затем асимптотически стремится к нулю. Кривая несимметрична относительно vв.

Барометрическая формула. Распределение Больцмана

Выражение (45.2) называется барометрической формулой.Она позволяет найти атмосферное давление в зависимости от высоты или, измерив давление, найти высоту. Так как высоты обозначаются относительно уровня моря, где давление считается нормальным, то выражение (45.2) может быть записано в виде
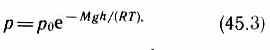
где р — давление на высоте h.
Прибор для определения высоты над земной поверхностью называется высотомером(или альтиметром).Его работа основана на использовании формулы (45.3). Из этой формулы следует, что давление с высотой убывает тем быстрее, чем тяжелее газ.
Барометрическую формулу (45.3) можно преобразовать, если воспользоваться выражением (42.6) p=nkT:

где n — концентрация молекул на высоте h, n0 — то же на высоте h=0. Так как M = m0NA (NA— постоянная Авогадро, m0 —масса одной молекулы), а R=kNA, то
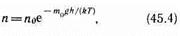
где m0gh=П — потенциальная энергия молекулы в поле тяготения, т. е.
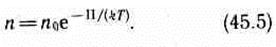
Выражение (45.5) называется распределением Больцманаво внешнем потенциальном поле. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
32. Среднее число столкновений и средняя длина свободного движения молекул.
Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь l, который называется длиной свободного пробега.В общем случае длина пути между последовательными столкновениями различна, но так как мы имеем дело с огромным числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул<l>.
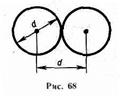
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулыd (рис.68). Он зависит от скорости сталкивающихся молекул, т. е. от температуры газа (несколько уменьшается с ростом температуры).
Так как за 1 с молекула проходит в среднем путь, равный средней арифметической скорости <v>, и если (z) —среднее число столкновений, испытываемых одной молекулой газа за 1 с, то средняя длина свободного пробега
<l>=<v>/<z>.
Для определения <z> представим себе молекулу в виде шарика диаметром d, которая движется среди других «застывших» молекул. Эта молекула столкнется только с теми молекулами, центры которых находятся на расстояниях, равных или меньших d, т. е. лежат внутри «ломаного» цилиндра радиусом d.
Среднее число столкновений за 1 с равно числу молекул в объеме «ломаного» цилиндра:
<z>=nV,
где n — концентрация молекул, V = = pd2<v> (<v> —средняя скорость молекулы или путь, пройденный ею за 1с). Таким образом, среднее число столкновений
<z>=npd2<v>.
Расчеты показывают, что при учете движения других молекул
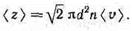
Тогда средняя длина свободного пробега

т.е. (l) обратно пропорциональна концентрации n молекул. С другой стороны, из (42.6) следует, что при постоянной температуре n пропорциональна давлению р.
Следовательно,

33. Явления переноса. Диффузия, вязкость, теплопроводность.
В термодинамически неравновесных системах возникают особые необратимые процессы, называемые явлениями переноса,в результате которых происходит пространственный перенос энергии, массы, импульса. К явлениям переноса относятся теплопроводность(обусловлена переносом энергии), диффузия(обусловлена переносом массы) и внутреннее трение(обусловлено переносом импульса). Для простоты ограничимся одномерными явлениями переноса. Систему отсчета будем выбирать так, чтобы ось х была ориентирована в направлении переноса.
1. Теплопроводность.Если в одной области газа средняя кинетическая энергия молекул больше, чем в другой, то с течением времени вследствие постоянных столкновений молекул происходит процесс выравнивания средних кинетических энергий молекул, т. е., иными словами, выравнивание температур.
Перенос энергии в форме теплоты подчиняется закону Фурье:
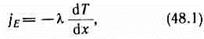
где jE — плотность теплового потока —величина, определяемая энергией, переносимой в форме теплоты в единицу времени через единичную площадку, перпендикулярную оси х, l — теплопроводность,dT/dx — градиент температуры, равный скорости изменения температуры на единицу длины х в направлении нормали к этой площадке. Знак минус показывает, что при теплопроводности энергия переносится в направлении убывания температуры
(поэтому знаки jЕ и dT/dx противоположны). Теплопроводность l, численно равна плотности теплового потока при градиенте температуры, равном единице. Можно показать, что
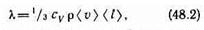
где Сv — удельная теплоемкость газа при постоянном объеме (количество теплоты, необходимое для нагревания 1 кг газа на 1 К при постоянном объеме), r — плотность газа, (v) —средняя скорость теплового движения молекул, <l> — средняя длина свободного пробега.
2. Диффузия.Явление диффузии заключается в том, что происходит самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел; диффузия сводится к обмену масс частиц этих тел, возникает и продолжается, пока существует градиент плотности.
Явление диффузии для химически однородного газа подчиняется закону Фика:
jm=-Ddp/dx (48.3)
где jт — плотность потока массы —величина, определяемая массой вещества, диффундирующего в единицу времени через единичную площадку, перпендикулярную оси х,D — диффузия (коэффициент диффузии),dr/dx—градиент плотности, равный скорости изменения плотности на единицу длины х в направлении нормали к этой площадке. Знак минус показывает, что перенос массы происходит в направлении убывания плотности (поэтому знаки jт и dr/dx противоположны). Диффузия D численно равна плотности потока массы при градиенте плотности, равном единице. Согласно кинетической теории газов,
D=1/3 <v> <l>. (48.4)
3. Внутреннее трение (вязкость).Механизм возникновения внутреннего трения между параллельными слоями газа (жидкости), движущимися с различными скоростями, заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, движущегося медленнее — увеличивается, что приводит к торможению слоя, движущегося быстрее, и ускорению слоя, движущегося медленнее.
Сила внутреннего трения между двумя слоями газа (жидкости) подчиняется закону Ньютона:

где h — динамическая вязкость (вязкость), dv/dx — градиент скорости, показывающий быстроту изменения скорости в направлении х, перпендикулярном направлению движения слоев, S — площадь, на которую действует сила F.
Динамическая вязкость h численно равна плотности потока импульса при градиенте скорости, равном единице; она вычисляется по формуле

Из сопоставления формул описывающих явления переноса, следует, что закономерности всех явлений переноса сходны между собой. Рассмотренные законы Фурье, Фика и Ньютона не вскрывают молекулярно-кинетического смысла коэффициентов l, D и h. Формулы (48.2), (48.4) и (48.7) связывают коэффициенты переноса и характеристики теплового движения молекул. Из этих формул вытекают простые зависимости между l, D и h:
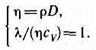
34. Первый закон термодинамики. Работа, теплота, теплоемкость, ее виды.
Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U1, получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U2, совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, а работа — положительной, когда система совершает ее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии DU=U2-U1 будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил:
DU=Q-A,
или
Q=DU+A. (51.1)
Уравнение (51.1) выражает первое начало термодинамики:теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
Выражение (51.1) в дифференциальной форме будет иметь вид
dQ=dU+dA,
где dU — бесконечно малое изменение внутренней энергии системы.