Теплота
Теплота - один из двух, известных современному естествознанию, способов передачи энергии - мера передачи неупорядоченного движения. Количество переданной энергии называют количеством теплоты.
а) изохорный процесс (V=const)
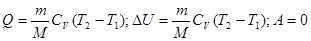
б) изобарный процесс (p=const)

в) изотермическом (T=const)

Теплоёмкость тела (обозначается C) — физическая величина, определяющая отношение бесконечно малого количества теплоты ΔQ, полученного телом, к соответствующему приращению его температуры ΔT:
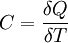
Единица измерения теплоёмкости в системе СИ — Дж/К.
Удельная теплоемкость веществавеличина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:

Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг•К)).
Молярная теплоемкость—величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
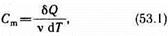
где v = m/M — количество вещества, выражающее число молей.
Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль•К)).
Удельная теплоемкость с связана с молярной Сm соотношением
Ст = сМ, (53.2)
где М — молярная масса вещества.
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа). Если речь идёт не о каком-либо теле, а о некотором веществе как таковом, то различают удельную теплоёмкость — теплоёмкость единицы массы этого вещества и молярную — теплоёмкость одного моля его.
Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоёмкость идеального газа с i степенями свободы при постоянном объеме равна:
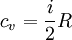
А при постоянном давлении

35. Политропный процесс, его частные случаи: изобарный, изотермический, адиабатный, изохорный.
Процесс, в котором теплоемкость остается постоянной, называется политропным.
Исходя из первого начала термодинамики при условии постоянства теплоемкости (C = const) можно вывести уравнение политропы:
pVn = const, (55.9) где n=(C-Ср)/(С-Cv) — показатель политропы. Очевидно, что при С = 0, n=g из (55.9) получается уравнение адиабаты; при С=¥, n =1 —уравнение изотермы; при С=СР, n = 0 — уравнение изобары, при С = Сv, n=±¥ —уравнение изохоры.
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются изопроцессы,при которых один из основных параметров состояния сохраняется постоянным.
Изохорный процесс(V = const). Диаграмма этого процесса (изохора)в координатах р, V изображается прямой, параллельной оси ординат (рис. 81), где процесс 1—2 есть изохорное нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.
dA=pdV = 0.
Как уже указывалось в § 53, из первого начала термодинамики (dQ=dU+dA) для изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии:
dQ =dU
Согласно формуле (53.4), dUm = CvdT.
Тогда для произвольной массы газа получим
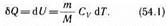
Изобарный процесс(р=const). Диаграмма этого процесса (изобара)в координатах р, V изображается прямой, параллельной оси V


. При изобарном процессе работа газа при расширении объема от V1 до V2 равна
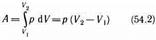
и определяется площадью прямоугольника, выполненного в цвете на рис. 82. Если использовать уравнение Клапейрона — Менделеева для выбранных нами двух состояний, то
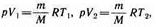
откуда
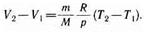
Тогда выражение (54.2) для работы изобарного расширения примет вид

Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2-T1=1К, то для 1 моля газа R=А, т. е. R численно равна работе изобарного расширения 1 моля идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой от количества теплоты
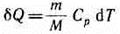
его внутренняя энергия возрастает на величину (согласно формуле (53.4))
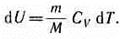
При этом газ совершит работу, определяемую выражением (54.3).
Изотермический процесс(T=const). Изотермический процесс описывается законом Бойля — Мариотта:
pV=const.
Диаграмма этого процесса (изотерма)в координатах р, V представляет собой гиперболу, расположенную на диаграмме тем выше, чем выше температура, при которой происходил процесс. Найдем работу изотермического расширения газа:

Так как при T=const внутренняя энергия идеального газа не изменяется:
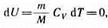
то из первого начала термодинамики (dQ =dU+dA) следует, что для изотермического процесса
dQ=dA,
т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
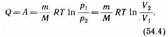
Следовательно, для того чтобы при работе расширения температура не уменьшалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
Адиабатический процесс. Политропный процесс
Адиабатическимназывается процесс, при котором отсутствует теплообмен (dQ=0) между системой и окружающей средой. К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.
Из первого начала термодинамики (dQ=dU+dA) для адиабатического процесса следует, что
dA=-dU, (55.1)
т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Для произвольной массы газа перепишем уравнение (55.1) в виде

Продифференцировав уравнение состояния для идеального газа pV=(m/M)RT, получим
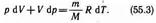
Исключим из (55.2) и (55.3) температуру Т:
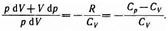
Разделив переменные и учитывая, что Ср/Сv =g найдем
dp/p=-gdV/V.
Интегрируя это уравнение в пределах от р1 до р2 и соответственно от V1 до V2, а затем потенцируя, придем к выражению
p2/pl=(V1/V2)g.
или
p1vg1 = p2vg2.
Так как состояния 1 и 2 выбраны произвольно, то можно записать
рVg=const. (55.4)
Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона.
36. Второй закон термодинамики. Энтропия. Тепловые двигатели и холодильные машины. Цикл Карно.
Второе начало термодинамикиможно сформулировать как закон возрастания энтропиизамкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Можно дать более краткую формулировку второго начала термодинамики: в процессах, происходящих в замкнутой системе, энтропия не убывает. Здесь существенно, что речь идет о замкнутых системах, так как в незамкнутых системах энтропия может вести себя любым образом (убывать, возрастать, оставаться постоянной). Кроме того, отметим еще раз, что энтропия остается постоянной в замкнутой системе только при обратимых процессах. При необратимых процессах в замкнутой системе энтропия всегда возрастает.
Формула Больцмана S = klnW, где k — постоянная Больцмана, позволяет объяснить постулируемое вторым началом термодинамики возрастание энтропии в замкнутой системе при необратимых процессах: возрастание энтропии означает переход системы из менее вероятных в более вероятные состояния. Таким образом, формула Больцмана позволяет дать статистическое толкование второго начала термодинамики. Оно, являясь статистическим законом, описывает закономерности хаотического движения большого числа частиц, составляющих замкнутую систему.