Термическое уравнение состояния
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:

P — давление,
V — объём,
T — абсолютная температура,
R — универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает притяжение молекул, поправка b — объём занимаемый молекулами.
Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
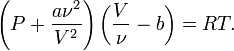
Внутренняя энергия (калорическое уравнение состояния)

где CV — молярная теплоёмкость при постоянном объёме, которая предполагается не зависит от температуры.
Таким образом, внутренняя энергия газа Ван-дер-Ваальса есть функция и температуры, и объёма, в следствие чего с ростом последнего (а значит, и расстояния между молекулами), при T = const, внутренняя энергия газа растет.
Изотермы:
Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса— кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса (p+a/V2m)(Vm-b)=RT. для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 89) имеют довольно своеобразный характер. При высоких температурах (T>Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Тк на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической,соответствующая ей температура Tк — критической температурой.Критическая изотерма имеет лишь одну точку перегиба К, называемую критической точкой;в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк и давлениерк называются также критическими.Состояние с критическими параметрами (рк, Vк, Тк) называется критическим состоянием.При низких температурах (Т<Тк) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.

Для пояснения характера изотерм преобразуем уравнение Ван-дер-Ваальса (61.2) к виду
pV3m-(RT+pb) V2m+aVm-ab=0.
Фа́зовый перехо́д (фазовое превращение) в термодинамике— переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход.
Наиболее часто рассматриваются фазовые переходы при изменении температуры, но при постоянном давлении (как правило равном 1 атмосфере). Именно поэтому часто употребляют термины «точка» (а не линия) фазового перехода, температура плавления и т. д. Разумеется, фазовый переход может происходить и при изменении давления, и при постоянных температуре и давлении, но при изменении концентрации компонентов (например, появление кристалликов соли в растворе, который достиг насыщения).