рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Механика
- /
- Див. також
Реферат Курсовая Конспект
Див. також
Див. також - раздел Механика, В теоретической механике изучается движение тел относительно других тел, представляющие собой физические системы отсчёта 91 Теплове́ Розши́рення — Зміна Геометричних Розмі...
91 Теплове́ розши́рення — зміна геометричних розмірів (об'єму) тіла внаслідок зміни його температури[1].
Ця властивість характерна для всіх речовин. Коли речовина нагрівається, її частинки починають інтенсивніше рухатися, що приводить до збільшення середніх відстаней між ними.
Більшість тіл збільшують свій об'єм в результаті зростання температури, однак відомо декілька винятків. Найвідомішими прикладами відхилення від правила є вода, яка в діапазоні від 0 °C до 4 °C зменшує свій об'єм при зростанні температури або чистий кремній при температурах між -255 °C та -153 °C.
Розділ метрології, що вивчає властивості та методи вимірювання теплового розширення має назву дилатометрія, а прилад для визначення параметрів теплового розширення — дилатометр.
Ступінь розширення речовини віднесений до зміни температури називається коефіцієнтом теплового розширення, що в цілому залежить від температури.
92 Теплоє́мність — фізична величина, яка визначається кількістю теплоти, яку потрібно надати тілу для зміни його температури на один градус.
Позначається здебільшого великою латинською літерою C. Питома теплоємність — теплоємність одиничної маси тіла, позначається малою латинською літерою c. Часто визначається також молярна теплоємність — теплоємність одного моля газу.
93 Адіаба́тний проце́с (грец. αδιαβατος — неперехідний) — в термодинаміці зміна стану тіла без обміну теплом з навколишнім середовищем. Його можна здійснити, проводячи стискання чи розширення тіла (наприклад, газу) дуже швидко.
Так, при поширенні звукових хвиль у повітрі чи іншому тілі, у місцях згущення частинок температура підвищується, а в місцях розрідження — знижується. За дуже малий період коливання не відбувається помітного обміну теплом між місцями згущення і розрідження.
Під час адіабатного стискування тіла внутрішня енергія його збільшується, а при адіабатичному розширенні — зменшується. Виконана робота при цьому дорівнює за величиною і протилежна за знаком зміні внутрішньої енергії системи.
94 Цикл (лат. cyclus, від грец. kuklos — круг) — завершена послідовність функціонування матеріально-технічних компонентів об'єкта (явища) в просторі та часі. Коло подій, явищ, частин.
95 ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
, пути изменения состояния термодинамич. системы. Процесс наз. обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежут. состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализир. случай, достижимый лишь при бесконечно медленном изменении термодинамич. параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы наз. необратимым.
Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия, теплопроводность, вязкое течение и др. Для хим. р-ции применяют понятия термодинамич. и кинетич. обратимости, к-рые совпадают только в непосредств. близости к состоянию равновесия. Р-ция А + В  С + D наз. кинетически обратимой или двусторонней, если в данных условиях продукты С и D могут реагировать друг с другом с образованием исходных в-в А и В. При этом скорости прямой и обратной р-ций, соотв.
С + D наз. кинетически обратимой или двусторонней, если в данных условиях продукты С и D могут реагировать друг с другом с образованием исходных в-в А и В. При этом скорости прямой и обратной р-ций, соотв.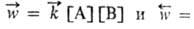
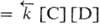 , где
, где 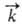 и
и 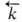 -константы скорости, [А], [В], [С], [D]- текущие концентрации (активности), с течением времени становятся равными и наступает химическое равновесие, в к-ром
-константы скорости, [А], [В], [С], [D]- текущие концентрации (активности), с течением времени становятся равными и наступает химическое равновесие, в к-ром -константа равновесия., зависящая от т-ры. Кинетически необратимыми (односторонними) являются обычно такие р-ции, в ходе к-рых хотя бы один из продуктов удаляется из зоны р-ции (выпадает в осадок, улетучивается или выделяется в виде малодиссоциированного соед.), а также р-ции, сопровождающиеся выделением большого кол-ва тепла.
-константа равновесия., зависящая от т-ры. Кинетически необратимыми (односторонними) являются обычно такие р-ции, в ходе к-рых хотя бы один из продуктов удаляется из зоны р-ции (выпадает в осадок, улетучивается или выделяется в виде малодиссоциированного соед.), а также р-ции, сопровождающиеся выделением большого кол-ва тепла.
На практике нередко встречаются системы, находящиеся в частичном равновесии, т. е. в равновесии по отношению к определенного рода процессам, тогда как в целом система неравновесна. Напр., образец закаленной стали обладает пространств. неоднородностью и является системой, неравновесной по отношению к диффузионным процессам, однако в этом образце могут происходить равновесные циклы мех. деформации, поскольку времена релаксации диффузии и деформации в твердых телах отличаются на десятки порядков. Следовательно, процессы с относительно большим временем релаксации являются кинетически заторможенными и могут не приниматься во внимание при термодинамич. анализе более быстрых процессов.
Необратимые процессы сопровождаются диссипатив-ными эффектами, сущностью к-рых является производство (генерирование) энтропии в системе в результате протекания рассматриваемого процесса. Простейшее выражение закона диссипации имеет вид:
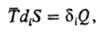
где  средняя т-ра, <diS-></d производство энтропии,
средняя т-ра, <diS-></d производство энтропии, - т. наз. нескомпенсированная теплота Клаузиуса (теплота диссипации).
- т. наз. нескомпенсированная теплота Клаузиуса (теплота диссипации).
Обратимые процессы, будучи идеализированными, не сопровождаются диссипативными эффектами. Микроско-пич. теория О. и н. п. развивается в статистической термодинамике. Системы, в к-рых протекают необратимые процессы, изучает термодинамика необратимых процессов.
96 Ентроп́ія S — в термодинаміці міра енергії у термодинамічній системі, яка не може бути використана для виконання роботи. Вона також є мірою безладдя, присутнього в системі. Властивості ентропії[ред. • ред. код]
Ентропія є екстенсивною величиною (залежить від маси і об'єму системи), тому сумарна ентропія двох систем

Ентропія є функцією стану системи, її зміна не залежить від способу переходу з кінцевого стану у початковий:
 ,
,
якщо обидва стани рівноважні.
У самочинних процесах, які протікають в ізольованій системі, ентропія зростає (ΔS>0). Ця властивість є основою другого закону термодинаміки. Виходячи з означення ентропії за Больцманом, у самочинних процесах в ізольованій системі безпорядок завжди зростає. Загалом, для довільної, не обов'язково ізольованої термодинамічної системи:
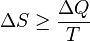 ,
,
де рівність виконується, за означенням, для рівноважних оборотних процесів.
Ентропія залишається сталою при рівноважних оборотних процесах в ізольованій системі, тобто системі, що не обмінюється ні енергією, ні частинками з іншими системами. У неізольованих термодинамічних системах зміна ентропії підпорядкована першому закону термодинаміки.
Процеси, що відбуваються зі сталою ентропією називаються ізоентропійними. Серед рівноважних процесів до таких належить адіабатичний процес. Ізоентропійними також можуть бути деякі нерівноважні процеси.
Похідна від термодинамічних потенціалів[ред. • ред. код]
Ентропію можна визнатити як похідну від термодинамічних потенціалів:
– Конец работы –
Эта тема принадлежит разделу:
В теоретической механике изучается движение тел относительно других тел, представляющие собой физические системы отсчёта
В теоретической механике изучается движение тел относительно других тел представляющие собой физические системы отсч та... Механика позволяет не только описывать но и предсказывать движение тел... Основные абстрактные модели реальных тел...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Див. також
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов