рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Механика
- /
- Реальные газы, жидкости и твердые тела
Реферат Курсовая Конспект
Реальные газы, жидкости и твердые тела
Реальные газы, жидкости и твердые тела - раздел Механика, БОРНИК ИНДИВИДУАЛЬНЫХ ЗАДАНИЙ по разделам: «Физические основы механики», «Молекулярная физика и термодинамика» · Уравнение Ван-Дер-Ваальса Для Одного Моля Газа ...
· Уравнение Ван-дер-Ваальса для одного моля газа
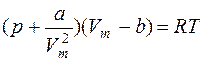 ,
,
для произвольного количества вещества ν газа
 ,
,
где а и b – постоянные Ван-дер-Ваальса (рассчитанные на один моль газа); V – объём, занимаемый газом; Vm – молярный объём;
p - давление газа на стенки сосуда.
Внутреннее давление, обусловленное силами взаимодействия молекул,
 , или
, или  .
.
· Связь критических параметров – объёма, давления и температуры газа – с постоянными а и b Ван-дер-Ваальса:
 ;
; 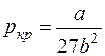 ;
; 
· Внутренняя энергия реального газа

где СV –молярная теплоёмкость газа при постоянном объёме.
· Поверхностное натяжение

где F – сила поверхностного натяжения, действующая на контур l, ограничивающий поверхность жидкость, или
 ,
,
где ∆E – изменение свободной энергии поверхностной плёнки жидкости, связанное с изменением площади ∆S – поверхности этой плёнки.
· Формула Лапласа в общем случае записывается в виде

где p-давление, создаваемое изогнутой поверхностью жидкости; σ - поверхностное натяжение; R1 и R2 – радиусы кривизны двух взаимно перпендикулярных сечений жидкости, а в случае сферической поверхности
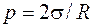
· Высота подъёма жидкости в капилярной трубке
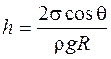
где θ – краевой угол; R-радиус канала трубки; ρ-плотность жидкости; g-ускорение свободного падения.
· Высота подъёма жидкости между двумя близкими и параллельными плоскостями
 ,
,
где d- расстояния между плоскостями.
· Закон Дюлонга и Пти
CV = 3R,
где CV – молярная (атомная) теплоемкость химически простых твердых тел.
8.1. Кислород (ν = 10 моль) находится в сосуде объемом V = 5 л. Определить: 1) внутреннее давление газа; 2) собственный объем молекул Поправки а и b принять равными соответственно 0,136 Н.м4/моль2 и 3,17.10-5 м3/моль. Ответ: 1) 544 кПа; 2) 79,3 см3.
8.2. Углекислый газ массой 6,6 кг при давлении 0,1 МПа занимает объем 3,75 м3. Определить температуру газа, если: 1) газ реальный; 2) газ идеальный. Поправки a и b принять равными соответственно 0,361 Н.м4/моль2 и 4,28.10-5 м3/моль. Ответ: 1) 302 К; 2) 301 К.
8.3. Углекислый газ массой 2,2 кг находится при температуре 290 К в сосуде вместимостью 30 л. Определить давление газа, если: 1) газ реальный; 2) газ идеальный. Поправки a и b принять равными соответственно 0,361 Н.м4/моль2 и 4,28.10-5 м3/моль. Ответ: 1) 3,32 МПа; 2) 4,02 МПа.
8.4. Плотность азота ρ = 140 кг/м3, его давление P = 10 МПа. Определить температуру газа, если: 1) газ реальный; 2) газ идеальный. Поправки a и b принять равными соответственно 0,135 Н.м4/моль2 и 3,86.10-5 м3/моль. Ответ: 1) 260 К; 2) 241 К.
8.5. Азот (ν = 3 моль) расширяется в вакуум, в результате чего объем газа увеличивается от V1 = 1 л до V2 = 5 л. Какое количество теплоты Q необходимо сообщить газу, чтобы его температура осталась неизменной? Поправку a принять равной 0,135 Н.м4/моль2. Ответ: 972 Дж.
8.6. Углекислый газ массой 88 г занимает при температуре 290 К объем 1000 см3. Определить внутреннюю энергию газа, если: 1) газ идеальный; 2) газ реальный. Поправку а принять равной 0,361 Н.м4/моль2. Ответ: 1) 14,5 кДж; 2) 13 кДж.
8.7. Кислород (ν = 2 моль) занимает объем V1 = 1 л. Определить изменение температуры кислорода, если он адиабатически расширяется в вакууме до объема V2 = 10 л. Поправку a принять равной 0,136 Н.м4/моль2. Ответ: –11,8 К.
8.8. Азот (ν = 2 моль) адиабатически расширяется в вакуум. Температура газа при этом уменьшается на 1 К. Определить работу, совершаемую газом против межмолекулярных сил притяжения. Ответ: 83,1 Дж.
8.9. Кислород (ν = 1 моль) (реальный газ), занимавший при T1 = 400 К объем V1 = 1 л, расширяется изотермически до V2 = 2V1. Определить: 1) работу при расширении; 2) изменение внутренней энергии газа. Поправки a и b принять равными соответственно 0,136 Н·м4/моль2 и 3,17·10-5 м3/моль. Ответ: 1) 2,29 кДж; 2) 68 Дж.
8.10. Определить радиус R капли спирта, вытекающей из узкой вертикальной трубки радиусом r = 1 мм. Считать, что в момент отрыва капля сферическая. Поверхностное натяжение спирта σ = 22 мН/м, а его плотность ρ = 0,8 г/см3. Ответ: 1,61 мм.
8.11. Давление воздуха внутри мыльного пузыря на ΔP = 200 Па больше атмосферного. Определить диаметр d пузыря. Поверхностное натяжение мыльного раствора σ = 40 мН/м. Ответ: 1,6 мм.
8.12. Воздушный пузырек диаметром d = 0,02 мм находится на глубине h = 25 см под поверхностью воды. Определить давление воздуха в этом пузырьке. Атмосферное давление принять нормальным. Поверхностное натяжение воды σ = 73 мН/м, а ее плотность ρ = 1 г/см3. Ответ: 118 кПа.
8.13. Вертикальный капилляр погружен в воду. Определить радиус кривизны мениска, если высота столба воды в трубке h = 20 мм. Плотность воды ρ = 1 г/см3, поверхностное натяжение σ = 73мН/м. Ответ: 744мкм.
8.14. Широкое колено U-образного манометра имеет диаметр d1 = 2 мм, узкое – d2 = 1 мм. Определить разность Δh уровней ртути в обоих коленах, если поверхностное натяжение ртути σ = 0,5 Н/м, плотность ртути ρ = 13,6 г/см2, а краевой угол θ = 138°. Ответ: 5,6 мм.
8.15. Используя закон Дюлонга и Пти, определить удельную теплоемкость: 1) натрия; 2) алюминия. Ответ: 1) 1,08 кДж/(кг·К); 2) 0,924 кДж/(кг·К).
8.16. Пользуясь законом Дюлонга и Пти, определить, во сколько раз удельная теплоемкость железа больше удельной теплоемкости золота. Ответ: 3,52.
8.17. Для нагревания металлического шарика массой 10 г от 20 до 50 °С затратили количество теплоты, равное 62,8 Дж. Пользуясь законом Дюлонга и Пти, определить материал шарика. Ответ: Олово, так как М = 0,119 кг/моль.
8.18. Изменение энтропии при плавлении 1 моль льда составило 25 Дж/К. Определить, насколько изменится температура плавления льда при увеличении внешнего давления на 1 МПа? Плотность льда ρ1 = 0,9 г/см3, воды ρ2 = 1 г/см3. Ответ: ΔT = –0,08 К.
Литература
1. Волькенштейн В.С. Сборник задач по курсу физики. – СПб.: СпецЛит, 2001.
2. Трофимова Т.И. Сборник задач по курсу физики для втузов. – М.: «Оникс 21 век», «Мир и Образование», 2003.
3. Чертов А.Г., Воробьев А.А. Задачник по физике. – М.: Интеграл-пресс, 1977.
– Конец работы –
Эта тема принадлежит разделу:
БОРНИК ИНДИВИДУАЛЬНЫХ ЗАДАНИЙ по разделам: «Физические основы механики», «Молекулярная физика и термодинамика»
УФИМСКИЙ ГОСУДАРСТВЕННЫЙ АВИАЦИОННЫЙ... ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ... СБОРНИК...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Реальные газы, жидкости и твердые тела
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов