Модели строения атома
Первые модели строения атома появляются в самом начале XX века. Жан Перрен в 1901 г. высказал предположение о ядерно-планетарном устройстве атома. Подобную же модель предложил в 1904 г. японский физик Хантаро Нагаока. В модели Нагаоки атом уподоблялся планете Сатурн; роль планеты выполнял положительно заряженный шар, представляющий собой основную часть объёма атома, а электроны располагались подобно спутникам Сатурна, образующим его кольца. Однако наиболее широкое распространение получила т.н. кексовая модель атома: в 1902 г. Уильям Томсон (лорд Кельвин) высказал предположение о том, что атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны. Простейший атом – атом водорода – представлял собой, по мнению У. Томсона, положительно заряженный шар, в центре которого находится электрон. Детально данную модель разработал Дж. Дж. Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца. Дж. Дж. Томсон предложил способ определения числа электронов в атоме, основанный на рассеивании рентгеновских лучей, основанный на предположении, что именно электроны должны являться центрами рассеивания. Проведённые эксперименты показали, что количество электронов в атомах элементов равно приблизительно половине величины атомной массы. Дж. Дж. Томсон, предположив, что число электронов в атоме непрерывно возрастает при переходе от элемента к элементу, впервые попытался связать строение атомов с периодичностью свойств элементов.
Немецкий физик Филипп фон Ленард попытался создать модель, не предполагающую раздельного существования в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц (т.н. динамид), каждая из которых является электрическим дуплетом. Выполненные Ленардом расчёты показали, что эти частицы должны иметь крайне малые размеры, и, следовательно, большая часть объёма атома представляет собой пустоту. Сосредоточение массы атома в небольшой части его объёма отчасти подтверждалось и проведёнными Ленардом в 1903 г. опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу.
Все упомянутые модели – Томсона-Томсона, Перрена-Нагаоки и Ленарда являлись сугубо гипотетическими и исключительно качественными.
| Первые модели строения атома: | |
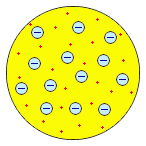 У. Томсон, 1902 г. У. Томсон, 1902 г.
| 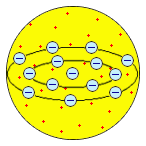 Дж. Дж. Томсон, 1904 г. Дж. Дж. Томсон, 1904 г.
|
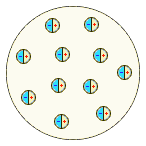 Ф. Ленард, 1904 г. Ф. Ленард, 1904 г.
| 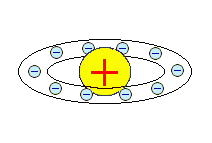 Х. Нагаока, 1904 г. Х. Нагаока, 1904 г.
|
В 1906-1909 гг. Ганс Гейгер, Эрнст Марсден и Эрнест Резерфорд, пытаясь найти экспериментальные подтверждения модели Томсона, провели свои знаменитые опыты по рассеиванию α-частиц на золотой фольге. Они использовали α-частицы вместо электронов, т.к. благодаря своей большей массе (в 7350 раз больше массы электрона) α-частицы не претерпевают заметного отклонения при столкновении с электронами, что позволяет регистрировать только столкновения с положительной частью атома. В качестве источника α-частиц ими был взят радий, а частицы, претерпевавшие рассеяние в тонкой золотой фольге, регистрировались по сцинтилляционным вспышкам на экране из сульфида цинка, находящемся в затемненной комнате.
Результат опытов оказался совершенно противоположным ожидаемому. Большинство α-частиц проходило через золотую фольгу по прямым или почти прямым траекториям, но в то же время некоторые α-частицы отклонялись на очень большие углы, что свидетельствовало о наличии в атоме чрезвычайно плотного положительно заряженного образования. Основываясь на этих экспериментальных фактах, Резерфорд в 1911 г. предложил свою ядерную модель атома: в центре атома находится положительно заряженное ядро, объём которого ничтожно мал по сравнению с размерами атома; вокруг ядра вращаются электроны, число которых приблизительно равно половине атомной массы элемента. Модель атома Резерфорда при несомненных достоинствах содержала важное противоречие: в соответствии с законами классической электродинамики вращающийся вокруг ядра электрон должен был непрерывно испускать электромагнитное излучение, теряя энергию. Вследствие этого радиус орбиты электрона должен был быстро уменьшаться, и рассчитанное из этих представлений время жизни атома оказывалось ничтожно малым. Тем не менее, модель Резерфорда послужила основой для создания принципиально новой теории, которую разработал в 1913 г. датский физик Нильс Хенрик Давид Бор.
Модель Бора опиралась на квантовую гипотезу, которую выдвинул в 1900 г. немецкий физик Макс Карл Эрнст Людвиг Планк. Планк постулировал, что вещество может испускать энергию излучения только конечными порциями, пропорциональными частоте этого излучения. Применив квантовую гипотезу для объяснения фотоэффекта, Альберт Эйнштейн в 1905 г. предложил фотонную теорию света.
Ещё одной предпосылкой для боровской модели атома стали серии спектральных линий водорода, которые обнаружили в 1885 г. швейцарский ученый Иоганн Якоб Бальмер, в 1906 г. американский физик Теодор Лайман и в 1909 г. немецкий физик Фридрих Пашен. Эти серии (в видимой, ультрафиолетовой и инфракрасной областях спектра) подчинялись очень простой закономерности: частоты были пропорциональны разности обратных квадратов целых чисел.
Бор объяснил устойчивость планетарной модели атома и одновременно эти спектральные данные с позиций квантовой теории, сформулировав ряд постулатов, накладывающих на модель атома квантовые ограничения. Согласно постулатам Бора, электрон может вращаться вокруг ядра лишь по некоторым определённым дозволенным ("стационарным") орбитам, находясь на которых, он не излучает энергию. Ближайшая к ядру орбита соответствует "нормальному" (наиболее устойчивому) состоянию атома. При сообщении атому кванта энергии электрон переходит на более удалённую орбиту. Обратный переход из "возбуждённого" в "нормальное" состояние сопровождается испусканием кванта излучения.
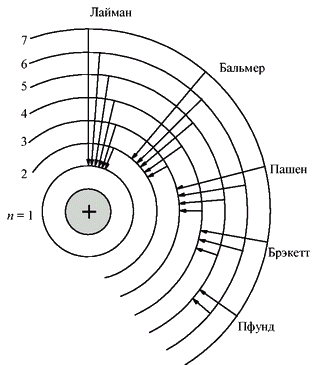
Как показал расчёт на основании спектральных данных, радиусы электронных орбит относятся как 12 : 22 : 32 : … : n2. Иначе говоря, момент количества движения вращающегося электрона пропорционален целочисленному главному квантовому число (номеру орбиты).
Максимально возможное число электронов на каждом уровне равно удвоенному квадрату главного квантового числа; это число оказалось равным количеству элементов в периодах периодической таблицы. Модель Бора, таким образом, выявила несомненную связь периодичности свойств элементов со строением электронных оболочек атомов.
Для атома водорода расчёты спектров на основе модели Бора дали хорошее согласие с экспериментом, но для других элементов получалось существенное расхождение с опытными данными. В 1916 г. немецкий физик Арнольд Иоганн Вильгельм Зоммерфельд уточнил модель Бора. Зоммерфельд высказал предположение, что кроме круговых, электрон может двигаться и по эллиптическим орбитам. При этом почти одинаковому уровню энергии соответствует число типов орбит, равное главному квантовому числу. Зоммерфельд дополнил модель побочным (орбитальным) квантовым числом (определяющим форму эллипсов) и зависимостью массы электрона от скорости. Основываясь на модели атома Бора-Зоммерфельда, представляющей собой компромисс между классическими и квантовыми представлениями (в классическую картину вводились квантовые ограничения), Нильс Бор в 1921 г. заложил основы формальной теории периодической системы. Причина периодичности свойств элементов, по мнению Бора, заключалась в периодическом повторении строения внешнего электронного уровня атома.
В 1925 г. Вольфганг Паули опубликовал свою работу, содержащую формулировку принципа запрета, носящего его имя: в данном квантовом состоянии может находиться только один электрон. Паули указал, что для характеристики состояния электрона необходимо четыре квантовых числа: главное квантовое число n, азимутальное квантовое число l и два магнитных числа m1 и m2. Вскоре после выхода работы Паули молодые физики Джордж Юджин Уленбек и Сэмюэл Абрахам Гаудсмит ввели в атомную физику представление о спине электрона. Американский физик Артур Холли Комптон, основываясь на атомных спектрах высокого разрешения, ещё в 1921 г. высказывал предположение о квантованном вращении электрона, а в следующем году Отто Штерн и Вальтер Герлах экспериментально наблюдали разделение пучка атомов серебра в магнитном поле на две части, соответствующие ориентации электронных спинов.
В 1927 г. немецкий физик Фридрих Хунд сформулировал эмпирические правила заполнения электронных оболочек. С применением запрета Паули и принципа насыщения уровней к 1927 г. была в целом построена электронная структура всех известных к тому времени 92 элементов. Создание учения о строении электронных оболочек атомов позволило создать формальную физическую теорию периодической системы, объяснившую причины периодичности свойств элементов и их соединений, а также создать первые теории химической связи.