З а д а н и е 1
1. Рассчитать, оформить в виде таблицы и построить графики зависимостей удельной, эквивалентной электропроводностей и степени диссоциации от концентрации и разведения по данным, приведенным в таблице.
2. Рассчитать константы диссоциации электролита для всех концентраций и сделать вывод о подчинении растворов закону разведения Оствальда.
3. Определить, при какой концентрации степень диссоциации вещества в растворе равна 0,1 и чему равно рН данного раствора.
4. Рассчитать изменение энергии Гельмгольца (ΔF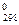 ) при диссоциации.
) при диссоциации.
Варианты заданий см. в табл.10-12.
Таблица 10
| № задания | С, моль/л | 0,05 | 0,03 | 0,01 | 0,005 | 0,003 | 0,001 | λ0.104 м2/Ом.моль-экв | ||||||
| Вещество | ρ (Ом.м) при Т=298 К | |||||||||||||
| HCN | ||||||||||||||
| HNO2 | 5,7 | 7,5 | 13,4 | 20,4 | 26,8 | 52,7 | ||||||||
| HClO | ||||||||||||||
| HCOOH | 8,91 | 10,3 | 18,3 | 25,9 | 35,8 | 68,5 | ||||||||
| CH3COOH | 27,6 | 34,8 | 61,0 | 87,0 | ||||||||||
| (CH3)2As-OOH | ||||||||||||||
| C6H5OH | ||||||||||||||
| C6H5COOH | 14,1 | 18,5 | 31,4 | 48,8 | 57,9 | |||||||||
| NH4OH | 10,3 | 14,5 | 25,8 | |||||||||||
б)
Таблица 11
| № задан-ия | V, л/моль | λ0.104 м2/Ом.моль-экв | ||||||
| Вещество | ρ (Ом.м) при Т=298 К | |||||||
| CHCl2COOH | 1,19 | 2,07 | 3,78 | 7,13 | 13,64 | 26,68 | ||
| C3H7COOН | 40,00 | 56,14 | 80,50 | 115,32 | 166,23 | 240,38 | ||
| изо-C3H7COOH | 39,02 | 55,17 | 78,53 | 112,78 | 162,54 | 236,49 | ||
| HCOOH | 10,26 | 14,81 | 21,62 | 31,76 | 47,06 | 71,61 | ||
| C2H5COOH | 41,03 | 57,66 | 82,58 | 117,97 | 170,10 | 247,94 | ||
| CCl3COOH | 0,93 | 1,80 | 3,52 | 6,89 | 13,58 | 26,98 | ||
| CH3COOH | 34,78 | 49,61 | 70,72 | 100,79 | 149,27 | 208,98 | ||
| CH2ClCOOH | 4,15 | 6,20 | 9,40 | 14,65 | 23,34 | 38,54 | ||
| NH4OH | 47,76 | 67,37 | 94,81 | 140,66 | 214,50 | 283,63 |
в)
Таблица 12
| № Задания | V, л/моль | λ0.104 м2/Ом. моль-экв | ||||||||
| вещество | ρ (Ом.м) при Т=298 К | |||||||||
| HCN | ||||||||||
| HNO2 | 5,70 | 7,50 | 13,40 | 20,40 | 26,80 | 52,70 | ||||
| HClO | ||||||||||
| (CH3)2AsOOH | ||||||||||
| C6H5OH | ||||||||||
| C6H5COOH | 4,73 | 6,20 | 10,40 | 16,30 | 19,30 | 34,80 | ||||
| n-ClC6H4OH | ||||||||||