Задача 3
Рассчитать степень окисления NO в NO2 для следующих исходных данных:
1. Расход нитрозных газов (НГ), нм3/ч 60000
2. Окислительный объем, м3 50
3. Давление, ат 7
4. Температура, оС 110
5. Начальная концентрация NO в НГ, % об. 4
6. Начальная концентрация O2 в НГ, % об. 5
Решение:
1) Т.к. реакция 2NO + O2 ↔ 2NO2 медленная, окисление NO будет продолжаться в течение времени пребывания газового потока в металлическом окислительном объеме. Вычислим это время пребывания τ. Для этого необходимо вначале рассчитать расход газа с учетом реальных температуры и давления. Используем уравнение Клайперона:

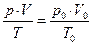 (10)
(10)

12025,118/3600 = 3,340 м3/с.
τ = 50/3,34 = 14,970 с.
2) Константа скорости реакции окисления при 110 оС равна: К110 = 0,00171 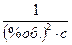 .
.
3) Рассчитаем а – половину начальной концентрации NO в газе, % об.:
а = 4/2 = 2 % об.
4) Определим γ = b/а – отношение концентрации О2 к половине концентрации NO:
γ = 5/2 = 2,5
5) Вычислим левую часть уравнения:
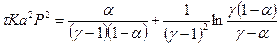 , (11)
, (11)
где a - степень окисления NO, доли ед.; t - время окисления, с; K – константы скорости реакции, 1/[(% об.)2×с]; а – половина начальной концентрации NO, % об.; Р – общее давление
газа, ат; 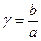 - отношение концентрации кислорода к половинной концентрации NO.
- отношение концентрации кислорода к половинной концентрации NO.
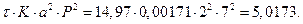
 6) Решением уравнения (11) является такое значение величины a, при котором левая часть равна правой части. Т.к. уравнение (11) нелинейное, величину a определяем методом итераций (подбора). Приблизительные значения a установим при помощи номограммы Каржавина:
6) Решением уравнения (11) является такое значение величины a, при котором левая часть равна правой части. Т.к. уравнение (11) нелинейное, величину a определяем методом итераций (подбора). Приблизительные значения a установим при помощи номограммы Каржавина:
a ≈ 0,88 – 0,89.
7) Уточняем величину a подстановкой a = 0,88; 0,885; 0,89 в правую часть уравнения (11), строим зависимость и определяем a.
Таблица 5.
| a | 0,88 | 0,885 | 0,89 |
| Правая часть | 4,139 | 4,363 | 4,609 |
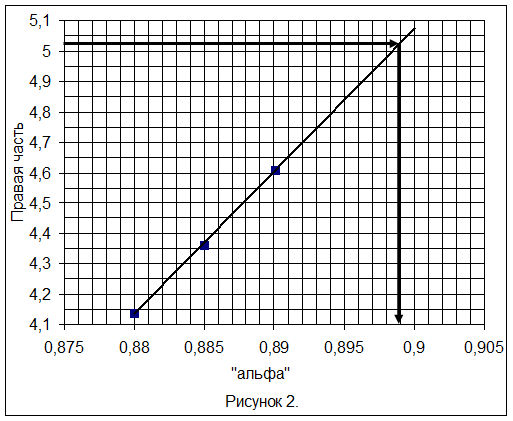
Из рисунка 2 следует: a = 0,899.
8) Рассчитаем состав нитрозного газа на входе в окислитель в нм3/ч:
NO: 0,04ּ60000 = 2400 нм3/ч;
О2: 0,05ּ60000 = 3000 нм3/ч.
Принимаем, что остальное в нитрозном газе – азот.
N2: 60000 – (2400 + 3000) = 54600 нм3/ч.
9) Изменения в составе нитрозного газа, связанные с протеканием реакции окисления NO:
Окислилось NO: 2400ּ0,899 = 2157,6 нм3/ч.
Осталось NO: 2400 – 2157,6 = 242,4 нм3/ч.
Затратилось О2: 2157,6/2 = 1078,8нм3/ч.
Осталось О2: 3000 – 1078,8 = 1921,2 нм3/ч.
 Образовалось NO2: 2157,6 нм3/ч.
Образовалось NO2: 2157,6 нм3/ч.
10) Состав нитрозного газа на выходе в нм3/ч и в % об.:
Таблица 6.
| Компонент | В нм3/ч | В % об. |
| NO | 242,4 | 0,41 |
| NO2 | 2157,6 | 3,66 |
| O2 | 1921,2 | 3,26 |
| N2 | 92,67 | |
| Всего | 58921,2 | 100,00 |