рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Вид работы: Расчетно-графические Задания
- /
- Задача 4
Реферат Курсовая Конспект
Задача 4
Задача 4 - Расчетно-графическое Задание, раздел Химия, РАСЧЕТНО-ГРАФИЧЕСКОЕ ЗАДАНИЕ по дисциплине: «химическая технология неорганических веществ» Составить Материальный И Тепловой Баланс Низкотемпературного ...
Составить материальный и тепловой баланс низкотемпературного конвертора СО производительностью по аммиаку 1200 т/сут. Расчет вести на 100 м3 сухого газа на входе.
Исходные данные:
Состав сухого газа на входе, % об.: Н2 – 60,41, N2 – 20,40, СО – 3,55, СО2 – 15,04, CH4 – 0,30, Ar – 0,30.
Объемное отношение на входе в реактор пар:сухой газ = 0,55.
Температура ПГС на входе в конвертор 225 оС.
Адиабатический разогрев смеси в результате конверсии равен 15 оС.
Соотношение между компонентами газа на выходе при условии достижения равновесия задается величиной константы равновесия реакции при температуре на выходе из реактора.
Давление газа на выходе 26 атм.
Потери тепла в окружающую среду принять равными 0,5% от прихода тепла.
Решение:
СО + Н2О ↔ СО2 + Н2.
Материальный и тепловой баланс решаются совместно. Неизвестной величиной является степень превращения оксида углерода (II), которую обозначим через a.
Условие теплового баланса:
Qприход = Qрасход. (12)
Уравнение теплового баланса:
Q1 + Q2 = Q3 + Q4, (13)
 где Q1 – физическое тепло ПГС на входе в конвертор, кДж; Q2 – тепло экзотермической реакции конверсии СО, кДж; Q3 – физическое тепло ПГС на выходе из конвертора, кДж; Q4 – потери тепла в окружающую среду, кДж.
где Q1 – физическое тепло ПГС на входе в конвертор, кДж; Q2 – тепло экзотермической реакции конверсии СО, кДж; Q3 – физическое тепло ПГС на выходе из конвертора, кДж; Q4 – потери тепла в окружающую среду, кДж.
1) Q1 = Vвх·cвх·tвх, (14)
где Vвх – объем ПГС на входе, м3; cвх – средняя объемная теплоемкость ПГС при температуре на входе, кДж/(м3·К); tвх – температура на входе, оС.
Объем ПГС на входе: Vвх = Vсух.газ + Vпар = 100 + 55 = 155 м3.
Расчет средней теплоемкости ПГС при 225 оС (498 К):
Таблица 7.
| Компонент | с, кДж/(м3·К) |
| Н2 | 1,291 |
| N2 | 1,321 |
| СО | 1,327 |
| СО2 | 1,874 |
| СН4 | 1,840 |
| Ar | 0,928 |
| Н2О | 1,539 |
Рассчитываем среднюю теплоемкость ПГС по формуле (2):
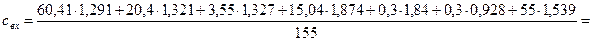
= 1,4407 кДж/(м3·К).
Q1 = 155·1,4407·225 = 50244,4 кДж.
2) Q2 = Vp·q, (15)
где Vр – объем фактически прореагировавшего СО, м3; q – теплота реакции, кДж/м3.
Объем фактически прореагировавшего СО выразим следующим образом:
Vp = a·VвхСО, (16)
где a - степень превращения СО, доли ед.; VвхСО – объем СО на входе, м3.
Теплоту реакции (в кДж/кмоль) рассчитаем по формуле [1]:
q = 44650 – 6,03·Т – 1,67·10-4·Т2 + 0,351·10-6·Т3. (17)
Среднюю температуру в слое катализатора ориентировочно примем равной:
(498 + 513)/2 = 505,5 К.
Тогда по (17):
q = 44650 – 6,03·505,5 – 1,67·10-4·505,52 + 0,351·10-6·505,53 = 41605 кДж/кмоль.
Q2 = VвхСО·q·a = 3,55·41605/22,4·a = (6593,65·a) кДж.
3) Выразим Qприход
 Qприход = Q1 + Q2 = (50244,4 + 6593,65·a) кДж.
Qприход = Q1 + Q2 = (50244,4 + 6593,65·a) кДж.
4) Q3 = Vвых·cвых·tвых, (18)
где Vвых – объем ПГС на выходе, м3; cвых – средняя объемная теплоемкость ПГС при температуре на выходе, кДж/(м3·К); tвых – температура на выходе, оС.
Т.к. реакция конверсии СО протекает без изменения числа моль реагентов, то объемы ПГС на входе и на выходе равны. Обозначим их через V.
Объем ПГС на выходе: V = Vвых = Vвх = 155 м3.
Расчет средней теплоемкости ПГС при 240 оС (513 К):
Таблица 8.
| Компонент | с, кДж/(м3·К) |
| Н2 | 1,291 |
| N2 | 1,322 |
| СО | 1,329 |
| СО2 | 1,885 |
| СН4 | 1,860 |
| Ar | 0,928 |
| Н2О | 1,542 |
Выразим состав ПГС на выходе:
VвыхСО = VвхСО - a·VвхСО; VвыхН2О = VвхН2О - a·VвхСО; VвыхН2 = VвхН2 + a·VвхСО;
VвыхСО2 = VвхСО2 + a·VвхСО.
Выразим среднюю теплоемкость ПГС по формуле (2):
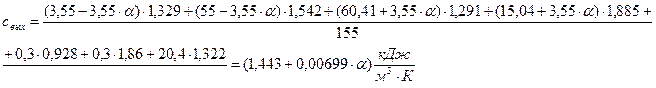
Q3 = 155·(1,443 + 0,00699·a)·240 = (53679,6 + 260,028·a) кДж.
5) Выразим Q4:
Q4 = (50244,4 + 6593,65·a)·0,005 = (251,22 + 32,968·a) кДж.
6) Выразим Qрасход:
Qрасход = Q3 + Q4 = 53679,6 + 260,028·a + 251,22 + 32,968·a = (53930,82 + 292,996·a) кДж.
7) Рассчитаем a, используя условие теплового баланса (12):
50244,4 + 6593,65·a = 53930,82 + 292,996·a
a = 0,585.
Тогда:
 Q2 = 6593,65·0,585 = 3857,3 кДж.
Q2 = 6593,65·0,585 = 3857,3 кДж.
Q3 = 53679,6 + 260,028·0,585 = 53831,7 кДж.
Q4 = 251,22 + 32,968·0,585 = 270,5 кДж.
Сведем полученные данные в таблицу теплового баланса.
Таблица 9.
Тепловой баланс конверсии СО второй ступени.
| Приход тепла | Расход тепла | ||||
| Поток тепла | кДж | % | Поток тепла | кДж | % |
| Физическое тепло газа на входе | 50244,4 | 92,87 | Физическое тепло газа на выходе | 53831,7 | 99,50 |
| Тепло реакции конверсии | 3857,3 | 7,13 | Потери тепла в окружающую среду | 270,5 | 0,50 |
| Всего | 54101,7 | Всего | 54102,2 |
Таким образом, тепловой баланс выполняется.
8) Рассчитаем состав ПГС на выходе.
Прореагировало СО: 0,585·3,55 = 2,08 м3 СО.
Столько же м3 прореагировало Н2О; столько же м3 образовалось СО2 и Н2.
Осталось СО: 3,55 – 2,08 = 1,47 м3 СО.
Осталось Н2О: 55 – 2,08 = 52,92 м3 Н2О.
Стало СО2: 15,04 + 2,08 = 17,12 м3 СО2.
Стало Н2: 60,41 + 2,08 = 62,49 м3 Н2.
Составим таблицу материального баланса.
Таблица 10.
Материальный баланс конверсии СО второй ступени.
| Приход | Расход | ||||
| Компонент | Объем, м3 | % | Компонент | Объем, м3 | % |
| Н2 | 60,41 | 38,98 | Н2 | 62,49 | 40,32 |
| N2 | 20,40 | 13,16 | N2 | 20,40 | 13,16 |
| СО | 3,55 | 2,29 | СО | 1,47 | 0,95 |
| СО2 | 15,04 | 9,70 | СО2 | 17,12 | 11,05 |
| СН4 | 0,30 | 0,19 | СН4 | 0,30 | 0,19 |
| Ar | 0,30 | 0,19 | Ar | 0,30 | 0,19 |
| Н2О | 35,49 | Н2О | 52,92 | 34,14 | |
| Всего | Всего |
Таким образом, материальный баланс сходится.
 |
 Литература
Литература
1. Расчеты по технологии неорганических веществ / Под ред. М.Е. Позина. – Л.: Химия, 1977. – 496 с.
2. Расчеты по технологии неорганических веществ /Под ред. П.В. Дыбиной. – М.: Высшая школа, 1967. – 524 с.
3. Химическая технология неорганических веществ: В 2 кн. Кн.1: Учеб. пособие для вузов /Под ред. Т.Г. Ахметова. – М.: Высш. шк., 2002. – 688 с., Кн.2. – 533с.
4. Краткий справочник физико-химических величин /Под ред. А.А. Равделя, А.М. Пономаревой. – СПб.: “Иван Федоров”, 2003. – 238 с.
5. Справочник азотчика. – Кн. 1. – М.: Химия, 1986. – 512 с. Кн. 2. – М.: Химия, 1987. – 464 с.
6. Технология связанного азота / Под ред. В.И. Атрощенко. – Киев: Вища школа, 1985. – 327 с.
7. Производство аммиака / Под ред. В.П. Семенова. – М.: Химия, 1985. – 368 с.
8. Курс технологии связанного азота. – М.: Химия, 1969.
– Конец работы –
Эта тема принадлежит разделу:
РАСЧЕТНО-ГРАФИЧЕСКОЕ ЗАДАНИЕ по дисциплине: «химическая технология неорганических веществ»
На сайте allrefs.net читайте: "РАСЧЕТНО-ГРАФИЧЕСКОЕ ЗАДАНИЕ по дисциплине: «химическая технология неорганических веществ»"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Задача 4
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов