Молекулярные кристаллы
Итак, близко расположенные молекулы притягиваются друг к другу вследствие диполь-дипольных (вандерваальсовых) взаимодействий, что может привести к переходу газа в конденсированное состояние (при понижении температуры или повышении давления).
Кристаллы с такими связями называют молекулярными (ван-дер-ваальсовыми). На рис. 31 показана кристаллическая решетка иода, I2. Показано, что и в кристалле сохраняются двухатомные молекулы. При переходе в кристаллическое (или жидкое) состояние характеристики ковалентных связей (длины, энергии, валентные углы) изменяются незначительно, так как величина межмолекулярного диполь-дипольного взаимодействия на 2–3 порядка меньше ковалентного, соединяющего атомы внутри молекул.

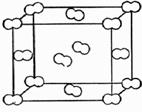 Поэтому молекулярные кристаллы непрочны термически и механически, температуры их плавления и кипения лежат в диапазоне ~ от 10 до 500 К. При бóльших температурах энергия тепловых движений частиц превышает энергию слабых межмолекулярных связей, кристаллы плавятся и испаряются, многие такие соединения представляют собой при н. у. газы (H2, Ar, CH4, С2Н4, CO2, Cl2 и др.), или жидкости (С5Н12, Br2, PCl3, CHCl3 и др.).
Поэтому молекулярные кристаллы непрочны термически и механически, температуры их плавления и кипения лежат в диапазоне ~ от 10 до 500 К. При бóльших температурах энергия тепловых движений частиц превышает энергию слабых межмолекулярных связей, кристаллы плавятся и испаряются, многие такие соединения представляют собой при н. у. газы (H2, Ar, CH4, С2Н4, CO2, Cl2 и др.), или жидкости (С5Н12, Br2, PCl3, CHCl3 и др.).

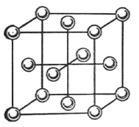 Межмолекулярная связь может иметь пространственную направленность, но не такую, как ковалентная связь, а связанную с разделением зарядов в молекуле. Если такого разделения нет, то нет и направленности связи и координационные числа принимают больши́е значения. На рис. 32 показана кристаллическая структура аргона, состоящая из плотноупакованных атомов Аr, связанных дисперсионными взаимодействиями. Отсутствие направленности связи приводит к тому, что атомы размещаются в пространстве так, чтобы занять максимально возможный объём (плотнейшую упаковку, для которой из чисто геометрических соображений КЧ = 12).
Межмолекулярная связь может иметь пространственную направленность, но не такую, как ковалентная связь, а связанную с разделением зарядов в молекуле. Если такого разделения нет, то нет и направленности связи и координационные числа принимают больши́е значения. На рис. 32 показана кристаллическая структура аргона, состоящая из плотноупакованных атомов Аr, связанных дисперсионными взаимодействиями. Отсутствие направленности связи приводит к тому, что атомы размещаются в пространстве так, чтобы занять максимально возможный объём (плотнейшую упаковку, для которой из чисто геометрических соображений КЧ = 12).
Низкая энергия и слабая направленность (в некоторых случаях – полное отсутствие направленности) межмолекулярных связей приводят к низкой твёрдости и высокой пластичности молекулярных кристаллов.
Энергия межмолекулярного взаимодействия зависит от полярности связей в молекулах и их поляризуемости. Чем больше поляризуемость, тем сильнее взаимодействие виртуальных диполей и межмолекулярная связь. Поэтому, например, температуры плавления и кипения простых веществ растут сверху вниз по подгруппам VIIA (от F2 к At2) и VIIIA (от He к Rn) ПС.
Молекулярные кристаллы – совокупность слабо связанных молекул, сохраняющих свою химическую индивидуальность. Слабые межмолекулярные связи нельзя рассматривать как химические. Естественно, что молекулярные кристаллы всегда стехиометричны.
Вандерваальсовые взаимодействия существуют в любых кристаллах, но в ковалентных и ионных их энергия пренебрежимо мала по сравнению с энергией химических связей.