Полярность молекулы (и полярность связи) характеризуется дипольным моментом молекулы (или связи).
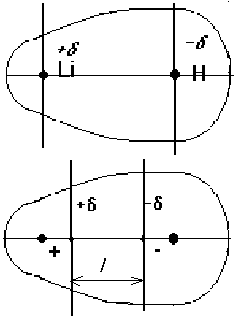
Величина дипольного момента сильно влияет на свойства полярных молекул и веществ, построенных из таких молекул. Полярные молекулы поляризуются в электрическом поле, устанавливаясь по силовым линиям поля, ориентируются в электических полях, создаваемых ионами в растворах, взаимодействуют между собой, замыкая свои электрические поля. Дипольный момент образуется за счет смещения центров положительного и отрицательного зарядов на некоторую величину l, называемую длиной диполя.
Чем более полярны молекулы, чем значительнее смещены валентные электронные пары к одному из атомов, тем больше m. И наоборот, если электрическая ассиметрия молекул незначительна, то величина m невлика .
Для системы из двух частиц дипольный момент m равен: m = el.
Где e- величина заряда;l- расстояние между центрами. Однако, определяя сразу величину дипольного момента, мы не знаем ни величины заряда e, локализованного в полярной молекуле, ни расстояния между центрами l.
Принимаем e равным заряду электрона(1,6021*10-19Кл) и тогда получаем приведенную длину диполя l, которая является условной величиной. В качестве единицы измерения дипольных моментов принят дебай(названный в честь голландского физика П.Дебая, разработавшего теорию полярных молекул).в системе СИ 1D=0,33*10-29Кл*м.
Дипольные моменты обычно определяют экспериментально, измеряя относительную диэлектрическую проницаемость e веществ при различных температурах. Если вещество поместить в электрическое поле, создаваемое конденсатором, то емкость последнего возрастет в e раз, т.е. e=c/c0 (где c0 и с- емкость конденсатора в вакууме и в среде вещества).
Энергия электрического поля в конденсаторе U выражается соотношением:
U=1/2cV2,
где V- напряжение на обкладках конденсатора.
Из приведенного уравнения видно, что конденсатор в среде вещества имеет больший запас энергии, чем в вакууме (с>1). Это обусловлено тем, что под действием электрического поля происходит поляризация среды - ориентация диполей и деформация молекул. Первый эффект зависит от температуры, второй - не зависит.
Температурную зависимость относительно диэлектической проницаемости вещества e выражает уравнение Ланжевена-Дебая:
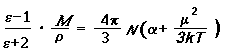 ’
’
где М- относительная молекулярная масса вещества; r- плотность вещества, NA- постоянная Авогадро; k- постоянная Больцмана, равная R/ NA (R- универсальная газовая постоянная); a- деформационная поляризуемость молекул.
Измерив e при двух температурах, с помощью уравнения Ланжевена-Дебая можно определить a и m. Есть и другие методы экспериментального определения m.
Значения дипольных моментов для некоторых связей между разнородными атомами приведены в таблице:

Не следует путать дипольный момент связи и дипольный момент молекулы, так как в молекуле могут существовать несколько связей, дипольные моменты которых суммируются как векторы. Кроме того, на величину дипольного момента молекулы могут влиять магнитные поля орбиталей, содержащих электронную пару,- "неподеленные" электроны. Большое влияние на полярность молекулы оказывает ее симметрия.
Например, молекула метана CH4 обладает высокой степенью симметрии (центрированный тетраэдр), и поэтому векторная сумма дипольных моментов связей (m=0,4D) равна нулю:
Smсв=0
Если заменить водородные атомы на атомы хлора и получить молекулу CCl4, у которой дипольный момент связи m=2,05D, те в пять раз больший, чем для C-H, то результат останется прежним, так как молекула CCl4 обладает таким же строением.
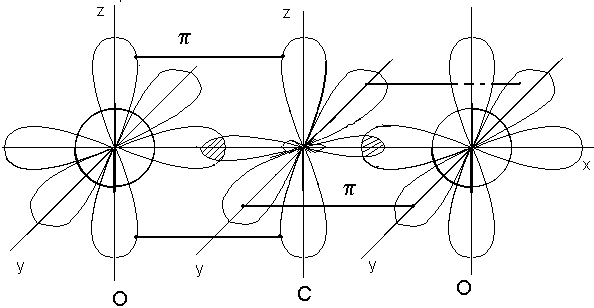
рис.2. схема строения молекулы СО2
Связь С=О обладает дипольным моментом 2,7D, однако линейная молекула СО2

 Является неполярной до тех пор, пока ее структура не исказится под действием других молекул(напр, Н2О).Структура линейной молекулы СО2, в которой атом углерода гибридизирован частично: 2s22p2 2s12p3 2q22p2 ,представлена на рис.2. Дипольные моменты связей, обладая различными знаками, дают общий депольный момент, равный нулю:
Является неполярной до тех пор, пока ее структура не исказится под действием других молекул(напр, Н2О).Структура линейной молекулы СО2, в которой атом углерода гибридизирован частично: 2s22p2 2s12p3 2q22p2 ,представлена на рис.2. Дипольные моменты связей, обладая различными знаками, дают общий депольный момент, равный нулю:
Smсв=0.
Таким образом, полярность молекул определяется довольно сложно, так как она учитывает все взаимодействия, которые могут возникнуть в такой сложной структуре, как молекула. Кроме того, ”полярность” молекулы не определяется лишь величиной дипольного момента, а зависит также от размеров и конфигурации молекул. Например, молекула воды более резко проявляет свои полярные свойства (образование гидратов, растворимость и т.д.), чем молекула этилового спирта, хотя дипольные моменты у них почти одинаковые (mн2о=1,84D; mс2н5он=1,70D).
Значения дипольных моментов для некоторых полярных молекул:
| молекула | m | молекула | m | молекула | m | молекула | m | молекула | m |
| Н2 | HF | 1,82 | Н2О | 1,84 | CO2 | CH4;CCl4 | |||
| О2 | HCl | 1,07 | Н2S | 0,93 | SO2 | 1,61 | CH3Cl | 1,86 | |
| N2 | HBr | 0,79 | NН3 | 1,46 | SO3 | CH2Cl2 | 1,57 | ||
| Cl2 | HI | 0,38 | PН3 | 0,55 | SF6 | CHCl3 | 1,15 |
Дипольный момент полярной молекулы может изменять свою величину под действием внешних электрических полей, а также под действием электрических полей других полярных молекул, однако при удалении внешних воздействий дипольный момент принимает прежнюю величину. Некоторые молекулы, неполярные в обычных условиях, могут получать так называемый индуцированный или “наведенный” дипольный момент, тоже исчезающий при снятии поля. Величина индуцированного момента в первом приближении пропорциональна напряженности электрического поля E: mинд=ae0E, гдеa- коэффициент поляризуемости, [a]=м3, e0-электрическая постоянная.
Физико-химические особенности полярных молекул определяются их способностью реагировать на внешние электрические поля (электрическая поляризация) и на поля, созданные другими полярными молекулами. В частности, за счет взаимодействия с полярными молекулами воды такие полярные молекулы, как HF, HCl и др.,могут подвергаться электролитической диссоциации.
Дополнительно используемая литература:
1.Общая и неорганическая химия. Карапетьян, Дракин
2. Теоретические основы общей химии. Горбунов, Гуров, Филиппов