Формулы для вычисления концентрации ионов водорода или
гидроксила в разбавленных растворах (без учета ионной силы раствора)
| Раствор | Формулы | Пример |
| Сильная кислота разбавленная (например, НС1) | [H+] ≈ cкисл. рН = ‑ lg cкисл. | сHCl = 0,1 моль-экв/л [H+] = 0,1 = 10-1; pH = 1 |
| Сильная щелочь разбавленная (например, NaOH) | [OH‾] ≈ cосн. рOН = ‑ lg cосн. рН = 14 ‑ рОН | сNaOH = 0,1; OH‾ = 10-1 pOH = 1; pH = 14 ‑ 1 = 13 |
| Слабая кислота (например, СН3СООН) | 
| 
|
| Слабая щелочь (например, NH4OH) | 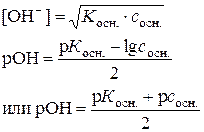 рН = 14 ‑ рОН рН = 14 ‑ рОН
| 
|
| Слабая кислота в присутствии ее соли (например, СН3СООН+ + СН3СООNa) | 
| 
|
| Слабая щелочь в присутствии ее соли (например, NН4ОН+ + NН4Сl) | 
| 
|
| Соль слабой кислоты и сильной щелочи (например, СН3СООNa) | 
| 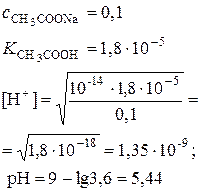
|
| Соль слабого основания и сильной кислоты (например, NH4Cl) | 
| 
|
| Соль слабой двухосновной кислоты (например, Na2CO3 | 
| 
|
| Кислая соль слабой двухосновнойкислоты (например, NaHCO3) | 
| 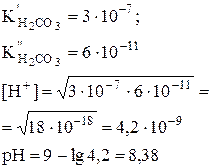
|
Таблица 2