рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- ИЗУЧЕНИЕ РАВНОВЕСИЯ ГОМОГЕННОЙ РЕАКЦИИ В РАСТВОРЕ
Реферат Курсовая Конспект
ИЗУЧЕНИЕ РАВНОВЕСИЯ ГОМОГЕННОЙ РЕАКЦИИ В РАСТВОРЕ
ИЗУЧЕНИЕ РАВНОВЕСИЯ ГОМОГЕННОЙ РЕАКЦИИ В РАСТВОРЕ - раздел Химия, ФИЗИЧЕСКАЯ ХИМИЯ Составитель: К.х.н., Доцент Котенко Г.а. ...
Составитель: к.х.н., доцент Котенко Г.А.
г. Череповец – 2006 г.
Цель работы:Формирование навыков экспериментального изучения равновесия гомогенной реакции в растворе:
FeCl3 + 2 KJ  2FeCl2 + J2 + 2KCl
2FeCl2 + J2 + 2KCl
при разных температурах, расчетов константы равновесия и термодинамических функций ΔН, ΔG и ΔS.
1. Теоретическая часть
Химические реакции делятся на гомогенные и гетерогенные. Гомогенными реакциями называют реакции, протекающие в пределах одной фазы. К гомогенным реакциям относятся многие химические процессы, протекающие в газовой фазе или в растворах. Например:
СО(г) + Н2О(г)  СО2(г) + Н2(г);
СО2(г) + Н2(г);
Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной. Например:
СаО(тв) + СО2(г)  СаСО3(тв);
СаСО3(тв);
Реакция протекает до равновесия, при котором имеются как продукты, так и исходные реагенты, и при этом не происходит изменение их концентраций. Термодинамическим условием химического равновесия является соотношение концентраций продуктов реакции и исходных веществ, при котором в реакционной системе dG = 0 (∑μ1dn1 = 0), причем энергия Гиббса имеет минимальное значение. Молекулярно-статистически химическое равновесие определяется как состояние, при котором скорости прямой и обратной реакций равны друг другу, при этом равновесие наступает тогда, когда состав смеси с течением времени при постоянных внешних условиях не меняется. Однако, неизменяемость состава смеси с течением времени может служить признаком, достаточным для констатирования наступившего равновесия лишь в том случае, если эта неизменяемость была достигнута в итоге самой реакции, т.е. при условии, что состав смеси до некоторого времени менялся вследствие реакции, а потом перестал меняться. Иногда состав смеси, в которой возможна химическая реакция, остается продолжительно неизменным, но не потому, что процесс уже закончился и наступило равновесие, а вследствие того, что без катализатора процесс протекает настолько медленно, что происходящие изменения не могут быть экспериментально обнаружены. Для установления равновесия можно воспользоваться вторым признаком равновесия – признаком его подвижности. Система, находящаяся в равновесии, может быть выведена из этого положения внешним воздействием. При прекращении воздействия система самопроизвольно возвращается в прежнее состояние. При изменении внешних условий (температуры, давления и т.п.) состав смеси будет изменяться. При возвращении системы к первоначальным условиям она будет переходить к исходному состоянию. Это означает, что рассматриваемое состояние является равновесным. Если же этого нет, то система не достигла еще состояние равновесия. Система, состояние которой характеризуется двумя признаками – неизменяемостью состава и подвижностью, - называется равновесной системой, а состав ее - равновесным составом. Состояние равновесия химической реакции характеризуется термодинамической константой равновесия Ка . Величина Ка выражается для данной химической реакции:
v1B1 + v2B2 + … = n1C1 + n2C2 + …
соотношение между активностями аi участвующих в ней веществ при
равновесии:
Ка =  .
.
Аналогичное соотношение между молярно- объемными концентрациями
выражает константу равновесия Кс. Когда к реакционной системе применимы
законы идеальных смесей ( идеальных газов, идеальных жидких растворов) Кс
при данной температуре имеет постоянное значение, не зависящее от исходных
концентраций реагентов.
Константу равновесия можно выразить через равновесные парциальные
давления системы:
Кр =  (1)
(1)
Равновесие системы может смещаться при изменении начальных
концентраций реагирующих веществ, константа же равновесия остается
неизменной. Поэтому, зная константу равновесия при каких-либо внешних
условиях, начальные концентрации и общее давление, можно рассчитать
равновесный выход.
При изучении химической реакции важно знать, будет ли она протекать, а
если будет, то в каком направлении. При р,Т = const реакция протекает
самопроизвольно в направлении уменьшении энергии Гиббса. Если все
реагирующие вещества подчиняются законам идеальных газов, то
уменьшение энергии Гиббса, наблюдаемое при обратимом протекании реакции
до состояния равновесия выражается уравнением:
 G = - RTlnKp + RT[(P
G = - RTlnKp + RT[(P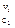 P
P …)/(P
…)/(P P
P …) ] (2)
…) ] (2)
где РС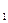 , РС
, РС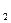 , РВ
, РВ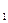 , РВ
, РВ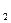 - произвольные парциальные давления исходных и
- произвольные парциальные давления исходных и
конечных веществ. Уравнение (2) позволяет установить влияние температуры,
давления инертного газа и начальных концентраций реагентов на
направленность химической реакции. В стандартном состоянии при всех
парциальных давлениях, равных 1 атм:
 G
G = - RTlnKp.
= - RTlnKp.
Зависимость константы равновесия от температуры описывается
уравнением изобары Вант – Гоффа:
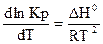 . (3)
. (3)
Где ΔН0 – изменение энтальпии (тепловой эффект) реакции. Чтобы вычислить
константу равновесия при любой температуре, следует проинтегрировать
уравнение Вант-Гоффа. При допущении независимости теплового эффекта от
температуры интегрирование уравнения (3) дает выражение:
ln Kp = -  (4)
(4)
где А = -  /RT, B - константа интегрирования.
/RT, B - константа интегрирования.
Или
ln (5)
(5)
2. Экспериментальная часть
Приборы и реактивы :термостат, колбы мерные с притертыми
пробками емкостью 100 см3, колбы конические для титрования емкостью 100 см3, пипетки, бюретка, 0,03 М раствор FeCl3, 0,03 M раствор КJ, 0,015 М раствор Na2S2O3, раствор крахмала.
– Конец работы –
Эта тема принадлежит разделу:
ФИЗИЧЕСКАЯ ХИМИЯ
На сайте allrefs.net читайте: ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ИЗУЧЕНИЕ РАВНОВЕСИЯ ГОМОГЕННОЙ РЕАКЦИИ В РАСТВОРЕ
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов