Порядок выполнения работы
Взять четыре пронумерованные сухие мерные колбы емкостью 100 см3,
налить в них растворы в соответствии с таблицей 1:
Таблица 1
| Раствор, см3 | Колба 1 | Колба 2 | Колба 3 | Колба 4 |
| 0,03 М FeCl3 | - | - | ||
| 0,03 М KJ | - | - |
Приготовить для титрования 8 конических колб емкостью 100 см3. В каждую
колбу налить 30-35 см3 дистиллированной воды и поставить для охлаждения на
лед. Слить вместе содержимое 1 и 2 колб, отметив момент сливания по часам.
Через 10 минут слить содержимое 3 и 4 колб и также отметить время. Колбы
плотно закрыть пробками. Через 20 минут после сливания из каждой колбы
отобрать пипеткой 15 см3 раствора и поместить их в колбы для титрования с
охлажденной водой. Время отбора пробы считать с точностью до 1 минуты.
Сразу после сливания выделившийся йод титровать 0,015 М раствором Na2S2O3
до бледно-желтой окраски. Затем добавить несколько капель раствора крахмала
и титровать до исчезновения синего окрашивания. Отбор проб повторить через
40, 60, 80 минут от момента сливания. Одинаковое количество (см3)
гипосульфита, израсходованное на титрование в двух последовательно взятых
пробах из каждой колбы, указывает на достижения равновесия в реакции.
Записать температуру опыта по комнатному термометру. Опытные данные
занести в таблицу 2.
Таблица 2
| Колбы | Т1, К | Результаты титрования , VNa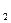 S S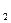 O O , см3 , см3
| |||
| Т1 | 20 мин | 40 мин | 60 мин | 80 мин | |
| 1 – 2 3 – 4 | |||||
| Колбы | Т2,К | 10 мин | 20 мин | 30 мин | 40 мин |
| 1 – 2 3 – 4 |
Повторить эксперимент при другой температуре (по указанию
преподавателя), помещая колбы с растворами в термостат и проводя отбор проб
через 10, 20, 30 и 40 минут от момента сливания. Экспериментальные данные
занести в таблицу 2.
3. Обработка экспериментальных данных
3.1.Расчет концентрации йода в состоянии равновесия:
СJ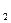 =
=  .
.
3.2. Расчет концентрации ионов Fe2+ : CFe = 2CJ
= 2CJ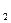 .
.
3.3. Расчет концентрации ионов Fe3+ : CFe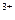 = CFeCl
= CFeCl - CFe
- CFe .
.
где CFeCl = C0 FeCl
= C0 FeCl .
.  ,
,
а и b – объемы растворов FeCl3 и KJ соответственно, взятые для проведения
реакции.
3.4. Расчет концентрации ионов J- : СJ = CKJ – 2CJ
= CKJ – 2CJ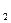 , где CKJ = C0 KJ .
, где CKJ = C0 KJ .  .
.
3.5. Расчет константы равновесия для двух опытов при двух температурах :
К =  .
.
3.6. Расчет среднего значения К для каждой температуры Т1 и Т2 :
КТ =  .
.
3.7. Занести в таблицу 3 данные расчетов.
Таблица 3
| Номер колбы | Температура | CJ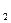
| CFe
| CFe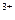
| СJ
| К | Кср |
| 1 – 2 | Т1 | К1 | КТ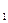
| ||||
| 3 – 4 | К2 | ||||||
| 1 – 2 | Т2 | К3 | КТ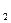
| ||||
| 3 - 4 | К4 |
3.8. Рассчитать изменение свободной энергии Гиббса при двух температурах:
ΔG = - RT1lnKT
= - RT1lnKT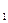 , ΔG
, ΔG = - RT2lnKT
= - RT2lnKT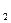 ,
,
где R = 8,314 Дж/моль.К.
3.9. Рассчитать изменение энтальпии по уравнению изобары Вант-Гоффа:
а) аналитически из уравнения:
ΔН =  .
.
б) графически из уравнения (4). Для этого необходимо построить график в координатах lnK = f(1/T) как показано на рисунке 1.
 ln K
ln K
 |

 ln KT2
ln KT2

 ln KT1
ln KT1
 |
1/T2 1/T1 1/T