Окислительно-восстановительные реакции.
9.1. Дайте оценку восстановительных свойств Мо и окислительно-восстановительных свойств его ионов в зависимости от его рН среды (используйте справочные характеристики).
9.2. Составьте уравнения 3-х окислительно-восстановительных реакций ( с использованием вещества содержащего ионы данного металла) при рН>7, рН=7, рН<7. 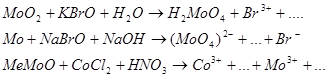
Предварительно рассчитайте Е0 химической реакции, используя метод электронно-ионного баланса.
10. Электрохимические свойства металла.
10.1. прогнозируйте отношение данного металла в компактном виде к атмосфере сухого воздуха (при комнатной температуре и нагревании), к влаге (без аэрации и при аэрации), к неокислительным и окислительным кислотам (на холоду и при нагревании), к растворам и расплавам щелочей.
10.2. Опишите процесс измерения стандартного электродного потенциала данного металла Cu и дайте термодинамический расчет этой величины.
10.3. Составьте и опишите схему гальванического элемента из металлического электрода данного металла и электродной системы С, 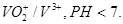
10.4. Опишите процесс электрохимической коррозии при контакте металла и изделия из Mg во влажной среде (Без аэрации и при аэрации). PH=10
10.5. Опишите процесс электролиза с учетом перенапряжения.
Электролит – раствор  PH= 4, 5
PH= 4, 5
Электроды: катод – Сu,
анод – Zn.