ВОПРОС 3. РАВНОВЕСИЕ В ПРОЦЕССАХ АДСОРБЦИИ
Независимо от природы адсорбционных сил количество вещества, адсорбированного единицей массы или объема определенного адсорбента, зависит от природы поглощенного вещества, температуры, давления и количества примесей в фазе, из которой поглощается вещество.
Зависимость между равновесными концентрациями поглощенного вещества в твердой и газовой или жидкой фазе в общем виде выражается уравнением
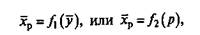 (1)
(1)

Зависимости, описываемые уравнениями (1), называются изотермами адсорбции. На основании законов химической термодинамики найдены конкретные выражения изотерм адсорбции, называемые изотермами Лэнгмюра:
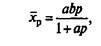 (2)
(2)
или Фрейндлиха:
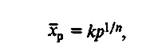

Адсорбции способствуют пониженная температура и повышенное давление над адсорбентом, а также отсутствие примесей в фазе над адсорбентом.
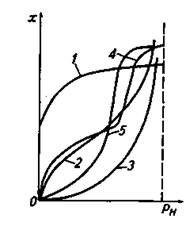
Вид изотермы адсорбции зависит от многих факторов: удельной площади поверхности адсорбента, объема пор, структуры адсорбента, свойств поглощаемого вещества, а также от температуры процесса. На рис. 21.1 изображены пять основных типов изотерм адсорбции. Тип 1 характерен для микропористых адсорбентов. Начальные выпуклые участки изотерм типов 2 и 4 также связаны с микропорами. Последующую форму изотерм определяют полимолекулярная адсорбция и капиллярная конденсация. Вогнутые участки на изотермах 3 и 5 характерны для систем адсорбент — адсорбтив, когда силы взаимодействия молекул адсорбтива с адсорбентом меньше сил межмолекулярного взаимодействия для молекул адсорбтива. Эти изотермы встречаются сравнительно редко.