Электроотрицательности атомов в стабильных степенях окисления по Полингу
| Период | Группы элементов | |||||||
| I | II | III | IV | V | VI | VII | VIII | |
| Н 2,1 | He | |||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | Ne | |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | Ar | |
| K 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,5 | V 1,6 | Cr 1,6 | Mn 1,5 | Fe 1,8 Co 1,8 Ni 1,8 | |
| Cu 1,9 Rb 0,8 | Zn 1,6 Sr 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 | Kr |
Электроотрицательность элементов периодической системы, как правило, последовательно возрастает слева направо в каждом периоде. В пределах каждой группы, за несколькими исключениями, электроотрицательность последовательно убывает сверху вниз. С помощью электроотрицательностей можно охарактеризовать химическую связь. Чем больше разница электроотрицательностей атомов, образующих химическую связь, тем больше степень ионности этой связи. Связи при разности электроотрицательностей атомов больше 2,1 могут считаться чисто ионными (по данным других научных источников, 50%-й ионности связи соответствует разность электроотрицательностей атомов, равная 1,7).
Связи с меньшей разностью электроотрицательностей атомов относят к полярным ковалентным связям. Чем меньше разность электроотрицательностей атомов, образующих химическую связь, тем меньше степень ионности этой связи. Нулевая разность электроотрицательностей атомов указывает на отсутствие ионного характера у образованной ими связи, т. е. на ее сугубую ковалентность.
Электроотрицательность атома, по-видимому, зависит и от степени его окисления. Так, для трех оксидов хрома: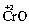 ,
,  ,
,  – наблюдается изменение их характера от основного (CrO) через амфотерный (Сr2O3) до кислотного (СrO3). Один и тот же элемент – хром – в СrO ведет себя как типичный металл, в Сr2O3 – как амфотерный металл, а в СrO3 – как типичный неметалл.
– наблюдается изменение их характера от основного (CrO) через амфотерный (Сr2O3) до кислотного (СrO3). Один и тот же элемент – хром – в СrO ведет себя как типичный металл, в Сr2O3 – как амфотерный металл, а в СrO3 – как типичный неметалл.
При составлении химических формул соединений следует учитывать, что более электроотрицательные элементы помещаются правее, например, H2S, OF2, SCl2O, Br3N, SiBr2F2.