рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Растворы
Реферат Курсовая Конспект
Растворы
Растворы - раздел Химия, Растворы I 1. Классификации Дисперсных Систем 2. Теория Растворов....
I
1. Классификации дисперсных систем
2. Теория растворов.
3. Законы Рауля
4. Осмотическое давление
5. ТЭД Аррениуса. Свойства растворов электролитов
6. Ионные реакции и их особенности
7. Ионное произведение воды. Водородный показатель
1. Классификации дисперсных систем
В окружающем нас мире растворы встречаются повсеместно: воздух представляет собой газообразный раствор О2, СО2 и других веществ в N2; морская вода – водный раствор целого ряда веществ (минерал. солей, газов, органических соединений); чугун – твердый раствор углерода в железе и т.д. Множество различных растворов содержится в организме человека и животных.
Если мы проанализируем известные нам химические реакции, то обнаружим, что большинство из них протекает в растворах. Поэтому изучение природы растворов важно со всех точек зрения.
Т.к. растворы являются частным случаем дисперсных систем, то с них и начнем рассмотрение вопроса.
Дисперсными называют такие системы, в которых одно или несколько веществ в виде мелких частиц распределены в другом веществе.
При этом распределяемое вещество принято называть дисперсной фазой, а вещество, в котором происходит распределение, - дисперсной средой.
| Дисперсные системы | Размеры частиц дисперсной системы | Устойчивость и гомогенность системы |
| Грубодисперсные (суспензии, взвеси) | 10-3…10-5 см (10…0,1 мкм) | Неустойчивы, гетерогенны |
| Тонкодисперсные (коллоидные растворы) | 10-5…10-7 см (0,1…0,001 мкм) | Довольно устойчивы, микрогетерогенны |
| Молекулярно-дисперсные (истинные растворы) | ~10-8 см | Весьма устойчивы, гомогенны |
Из таблицы следует, что для грубодисперсных систем размер частиц дисперсной фазы значительный, что позволяет им сохранить все свойства фазы, поэтому такие системы рассматриваются как гетерогенные. В истинных растворах степень дробления вещества соответствует размерам молекул (ионов), следовательно, исчезает поверхность раздела и система становится гомогенной. Исходя из этого, раствором можно назвать однородную, гомогенную систему переменного состава, состоящую из двух и более компонентов.
Растворы могут существовать в любом агрегатном состоянии – твердом, жидком или газообразным. Общим признаком для них является однофазность, так что в растворе нельзя различить частицу одного компонента от другого.
Т.о., дисперсные системы можно классифицировать по типу агрегатного состояния.
| Дисперсная среда | Дисперсная фаза | Примеры |
| Газ | газ жидкость твердое тело | газовые смеси (воздух) туманы, облака пыль, дым |
| Жидкость | газ жидкость твердое тело | пена эмульсии (молоко, кремы, мази), суспензии, взвеси (глина в воде) |
| Твердое тело | газ жидкость твердое тело | твердые пены(пенопласты, пемза, пеностекло) твердые эмульсии (вода в парафине, жемчуг) сплавы, твердые растворы |
Компонентами раствора являются растворитель (среда) и растворенное вещество (или несколько). Под растворителем обычно понимают то вещество, которое находится в том же агрегатном состоянии, что и раствор в целом. Если агрегатное состояние веществ, составляющих раствор одинаковое, то растворителем называют то из них, которое преобладает в данной системе. Например, в 5% растворе сахара в воде сахар является растворенным веществом, а вода – растворителем. В целом понятия «растворитель» и «растворенное вещество» имеют до некоторой степени условный характер. Например, в концентрированных растворах различие между растворителем и растворимым веществом менее очевидно. Для 50%-ного раствора этанола и воды оба понятия становятся равноправными, а для раствора, в котором 95% спирта и 5% воды, вода должна быть растворенным веществом. Но для растворов электролитов вода всегда является растворителем, даже если ее и очень мало. Поэтому понятия «растворитель» и «растворенное вещество» целесообразно использовать в применении к разбавленным (неконцентрированным) растворам.
Наиболее часто встречаются и рассматриваются системы жидкость в жидкости и твердое в жидкости. Они имеют особое значение в природе, обеспечивая достаточно быстрое протекание многих геохимических и всех биологических процессов; они широко применяются в практике. Особенностью таких систем является совмещение двух важных для течения химической реакции характеристик: высокой концентрации вещества, характерной для конденсированных систем, и высокой подвижности компонентов, что обеспечивает большую скорость процесса.
2. Теория растворов.
В XIX веке развивались две крайние теории растворов: химическая, в которой все свойства растворов пытались объяснить образованием в них различных химических соединений (Д.И. Менделеев и др.) и физическая, в которой растворенное вещество рассматривалось как газ, который заполняет инертный растворитель (Вант-Гофф, Аррениус и др).
Возражения сторонников химич. теории растворов:
1. Почему нет химической связи между ионами и молекулами растворителя?
2. Почему противоположно заряженные ионы не объединяются попарно?
3. Откуда берется энергия для разделения вещества на ионы при растворении?
4. Почему именно те вещества, которые образуются с наибольшим выделением энергии и имеют наибольшую прочность связи, легче всего распадаются на ионы?
Сторонники С.Аррениуса, наоборот, относились отрицательно к гидратации и не верили в теорию растворов Менделеева. Огромное значение для развития теории электролитической диссоциации имело личное знакомство и совместная работа С.Аррениуса с Я.Вант-Гоффом и В.Оствальдом. Оствальд вначале также не мог принять ТЭД. Вспоминая июль 1884г., он говорил:"Я провел лихорадочную ночь со скверными снами… У меня одновременно появилась жестокая зубная боль, новорожденная дочка и статья Аррениуса "Исследования по проводимости электролитов".
Электролиты - это вещества, распадающиеся в растворе на ионы под действием молекул полярного растворителя, т.е.подвергающиеся электролитической диссоциации.
Неэлектролиты в растворах или расплавах представляют собой отдельные молекулы веществ, не распавшихся на ионы под влиянием молекул растворителя.
В современной теории растворов признается важность как физических, так и химических сил между молекулами, т.е. диффузия молекул вещества сопровождается взаимодействием.
При образовании жидкого раствора происходит не только очевидное изменение растворяемого вещества, но изменяется и растворитель. Строение жидкого раствора в общем виде можно представить как равновесную систему, состоящую из трех основных зон. Каждая зона характеризуется своими структурными особенностями, а между зонами происходит непрерывный обмен.
Катион в полярном р-ле
а – зона сольватированного иона
б – зона деструктурированного р-ля
в – структура растворителя
Образование зоны а – это процесс образования сольватов (в случае воды гидратов), т.е. процесс образования соединений между растворенным веществом и растворителем. Зона б – зона деструктурированного растворителя; ее существование – следствие существования зон а и б с разной структурой.
Обычно процесс растворения сопровождается заметным тепловым эффектом. Количество теплоты, поглощающееся или выделяющееся при растворении 1 моля вещества в определенном количестве растворителя (как правило, бесконечно большом), называется интегральной теплотой растворителя ∆Н данного вещества.
экзо –
эндо –
В общем случае ∆Н растворения твердого вещества в жидкости может быть представлена суммой нескольких слагаемых:
∆Н1 – Е на разрушение кристаллической решетки твердого вещества (>0)
∆Н2 – Е на разрыв связей между молекулами растворителя (>0)
∆Н3 – Е на распределение частиц растворяемого вещества между молекулами растворителя (>0)
∆Н4 – Е взаимодействие частиц растворенного вещества с молекулами растворителя и образования новых связей между ними (<0)
Образующиеся сольваты или гидраты могут быть настолько прочными, что при выделении растворенного вещества из раствора растворитель входит в состав растущего кристалла в химически связанном виде. Такие вещества называются кристаллическими.
Na2SO4·10H2O – глауберова соль
CuSO4·5H2O – медный купорос
3. Законы Рауля
Для жидких и твердых тел важной характеристикой является давление пара, определяющее состояние равновесия между конденсированной и газообразной фазами.
Давление насыщенного пара пропорционально числу газообразных частиц в состоянии равновесия (Uиспар. = Uконденс.). Давление насыщенного пара каждого вещества есть величина постоянная при данной температуре, с повышением температуры давление пара увеличивается. При tкипения давление пара равно внешнему давлению, при tзамерзания давления пара над веществом в жидком и твердом состояниях одинаково.
Франсуа Рауль экспериментально показал, что если в жидкости растворено нелетучее вещество, то давление насыщенного пара над раствором меньше давления насыщенного пара над чистым растворителем.
Понижение давления пара вызвано тем, что
поверхность раствора,
в отличие от
поверхности раствори-
теля частично занято
частицами нелетучего
растворенного вещества. Это приводит к уменьшению числа молекул растворителя, испаряющихся в единицу времени; число же молекул растворителя, переходящего из газа в раствор, остается без изменения. Однако основную роль играют силы сольватационного взаимодействия. Они значительно прочнее сил сцепления между молекулами растворителя, чем и объясняется переход меньшего числа молекул растворителя в газовую фазу.
Первый закон Рауля:
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
 n – число молей растворенного вещества
n – число молей растворенного вещества
N – число молей растворителя.
Отсюда можно вычислить давление пара над раствором p и абсолютное понижение давления пара ∆p

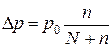
Одновременно с понижением давления пара над раствором наблюдается изменение его tкип и tзам : tкип↑, tзам↓ с температурами для чистых растворителей.
замерзание воды – т.А
кипение воды - т.В
Кривая АВ характеризует изменение давления водяного пара в интервале 0-100° С
Кривая АС – изменение давления пара льда при t°<0°С
Т.к давление пара раствора
ниже давления пара растворителя
изменение его давления будет характеризоваться кривой А1В1,
все точки которой располагаются ниже
соответствующих точек кривой АВ для чистого растворителя. В т.Д при 100°С давление пара меньше атмосферного, => раствор не закипает. В точке В1 достигается равенство давлений, т.е tкип раствора = 100°С+∆ tкип
Аналогично, tзам раствора = 0°С - ∆ tзам растворителя
Экспериментально установлено, что ∆ tкип и ∆ tзам пропорциональны моляльности раствора. Для одномоляльных растворов различных электролитов независимо от их состава изменение tкип и tзам происходит на одну и ту же величину.
Второй закон Рауля:
Повышение tкип и повышение tзам растворов пропорциональны моляльной концентрации растворенного вещества:
Этот закон показывает, что свойства растворов зависят только от числа частиц растворенного вещества (а не от природы, их размеров и т.п.).
4. Осмотическое давление.
Если поверх раствора какого-либо вещества, помещенного в цилиндрический сосуд, осторожно налить, избегая перемешивания, слой более разбавленного раствора этого вещества или чистого растворителя, то спустя некоторое время концентрация растворенного в-ва будет одинаковой по всему объему раствора. Такое выравнивание концентраций связано со стремлением частиц обоих компонентов раствора к равномерному распределению по всему объему. При этом частицы растворенного вещества, проявляя общую тенденцию к увеличению неупорядоченности (то есть энтропии), переходят из области более концентрированного раствора или чистого растворителя, а частицы растворителя двигаются в противоположном направлении.
Процесс перемещения веществ, приводящий к выравниванию их концентраций и обусловленный тепловым движением частиц, называется ДИФФУЗИЕЙ.
Рассмотрим особый случай диффузии, когда на границе между раствором и растворителем или между двумя растворами различной концентрации находится перегородка, проницаемая для молекул растворителя и задерживающая частицы растворенного вещества. Диффузия молекул растворителя через полупроницаемую перегородку (мембрану) получила название ОСМОСА. Явление осмоса можно наблюдать с помощью прибора, называемого осмометром. Схема простейшего осмометра такова: сосуд с раствором, закрытый снизу полупроницаемой мембраной, помещается в стакан с водой. При этом раствор поднимается по трубке вверх за счет того, что число молекул воды, проходящих через мембрану в единицу времени в направлении от растворителя к раствору, больше числа молекул воды, проникающих через мембрану в обратном направлении. Через некоторое время подъем жидкости в трубке прекратится, и ее уровень достигнет высоты h над уровнем жидкости в стакане.
Прекращение подъема жидкости в трубке означает, что в системе установилось состояние равновесия, при котором число молекул растворителя, диффундирующих во взаимно противоположных направлениях, одинаково. Чем больше концентрация растворенного вещества, тем больше молекул растворителя пройдет через мембрану и, следовательно, тем больше будет высота столба жидкости, необходимого для прекращения осмоса.
Таким образом, раствор лишь в том случае находится в равновесии с растворителем при наличии разделяющей их полупроницаемой перегородки, если к последней со стороны раствора приложено некоторое избыточное давление, называемое ОСМОТИЧЕСКИМ. Следует отметить, что осмотическое давление проявляется в системе, состоящей из растворителя, раствора и полупроницаемой мембраны.
Бытовой пример про жарку картошки – когда её солить
Осмотическое давление раствора изменяется с концентрацией растворенного вещества и с температурой, причем эта зависимость по форме совпадает с законом для идеальных газов. Такая аналогия возможна только для разбавленных растворов неэлектролитов.
Разбавленными считают растворы, в которых молекулы растворенного вещества практически не взаимодействуют друг с другом, и дальнейшие разбавления таких растворов не изменяет их энтальпию (внутреннюю энергию).
Первые исследования осмотического давления водных растворов
тростникового сахара произвел В.Пфеффер в 1877г. По его данным через 10 лет
Якоб Вант-Гофф установил зависимость осмотического давления от концентрации растворенного вещества:
– Конец работы –
Эта тема принадлежит разделу:
Растворы
Кстати в списке лауреатов Нобелевской премии по химии имя Вант Гоффа стоит первым Нобелевскую премию он получил в г quot за открытие законов... Свойства растворов электролитов...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Растворы
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов