рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Загальна характеристика розчинів електролітів
Реферат Курсовая Конспект
Загальна характеристика розчинів електролітів
Загальна характеристика розчинів електролітів - раздел Химия, Розчини електролітів Електролітами Називаються Речовини, Розчини Чи Розпла...
Електролітами називаються речовини, розчини чи розплави яких проводять електричний струм за рахунок іонів, що утворюються внаслідок дисоціації молекул електроліту. Ці положення були сформульовані в теорії електролітичної дисоціації шведським ученим Сванте Арреніусом (1887):
1) розчинення електроліту супроводиться розпадом його молекул на іони;
2) при дії постійного електричного струму позитивні іони рухаються до катода, а негативні – до анода (перші називаються катіонами, а другі – аніонами);
3) електролітична дисоціація є оборотним процесом.
Подальший розвиток теорія електролітичної дисоціації дістала в роботах російських хіміків І.А.Каблукова, В.А.Кистяковського і П.В.Писаржевського.
Основна причина утворення іонів – це іон-дипольна взаємодія між розчинником і розчиненою речовиною. Чим більша полярність молекул розчинника і чим більший полярний чи іонний зв’язок у молекулах електроліту, тим сильніше проявляється ця взаємодія й електроліти краще дисоціюють на іони.
Здатність електроліту дисоціювати на іони кількісно оцінюють за допомогою ступеня дисоціації a, який є відношенням числа молекул, що розпалися на іони (Сдис), до загального числа розчинених молекул (Сзаг ) (може виражатися в долях одиниці, або у відсотках).
 , 0 ≤ α ≤1
, 0 ≤ α ≤1
Наприклад, якщо a=30%, це означає, що із 100 молекул електроліту розпалося на іони лише 30.
Ступінь дисоціації електроліту залежить від природи розчинника й розчиненої речовини, температури, концентрації розчину, наявності однойменних іонів.
Усі електроліти умовно поділяють на сильні (a>0,3), середньої сили (0,03<a<0,3) і слабкі (a<0,03).
До сильних електролітів відносять майже всі солі, багато кислот: HCl, HBr, HNO3, H2SO4, HClO4, HMnO4, гідроксиди лужних і лужноземельних металів.
Сильні електроліти у водних розчинах цілком розпадаються на іони, тобто процес дисоціації сильних електролітів є необоротним. Тому при написанні рівнянь дисоціації сильних електролітів використовують знак рівності. Наприклад:
NaCl=Na++Cl-
CuSO4=Cu2++
До слабких електролітів відносять майже всі органічні кислоти, деякі неорганічні кислоти (H2CO3, H2S, H3PO4, HCN, H2SiO3, HClO, HNO2, H2SO3 та ін.), слабо розчинні гідроксиди металів, а також добре розчинний, але слабо дисоціюючий гідроксид амонію NН4ОН (NH3·H2O).
Процес дисоціації слабких електролітів оборотний, рівновага сильно зміщена в напрямку утворення молекул електроліту. Тому процес дисоціації таких електролітів зображають за допомогою знака оборотності («).
HClO « Н+ + СlO-
За характером утворених іонів усі електроліти поділяють на три групи: кислоти, основи і солі.
Кислоти. Молекули кислот складаються із атомів водню і кислотних залишків. Тому при дисоціації будь-якої кислоти у розчині утворюються позитивно заряджені іони водню й різні аніони:
HNO3=Н++ ; H2SO4=2Н++
; H2SO4=2Н++
Дисоціація багатоосновних слабких кислот йде ступінчасто:
H2СO3«Н++
 «Н++
«Н++
Основи. Основами (гідроксидами) називають електроліти, що при дисоціації у розчині утворюють лише один вид аніонів – гідроксид-іони і різні катіони
NaOH=Na++OH-; NH4OH« +OH-
+OH-
Багатокислотні гідроксиди дисоціюють ступінчасто:
Cu(OH)2«CuOH++OH-
CuOH+«Cu2++OH-
Амфотерні гідроксиди (амфоліти). До амфотерних відносять гідроксиди, які залежно від умов можуть взаємодіяти як із кислотами, так і з основами. Це Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2, Al(OH)3, Cr(OH)3 і деякі інші. Така поведінка амфотерних гідроксидів пояснюється тим, що в їх молекулах міцність зв’язків Ме-О і О-Н приблизно однакова. Тому амфоліти можуть дисоціювати і за типом кислоти і за типом гідроксиду:
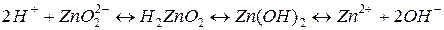
Солі – це електроліти, що утворюють при розчиненні у воді іони металів і кислотних залишків. Солі бувають середні, кислі і основні. Розчинні середні солі є сильними електролітами і дисоціюють повністю на іони.
Кислі солі утворені за рахунок іонного та полярного типу хімічного зв’язку. Тому дисоціація кислої солі йде ступінчасто: на першому ступені – цілком (у результаті розриву іонного зв’язку), а на другому – незначно (внаслідок розриву ковалентного полярного зв’язку):
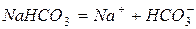

До складу основних солей входять гідроксильні групи. Основні солі погано розчиняються у воді й дисоціюють ступінчасто:
Cu(OH)Cl=Cu(OH)++Cl-, Cu(OH)+«Cu2++OH-,
Основні солі слабкої основи майже не дисоціюють за другим ступенем. Тому в розчині основної солі гідроксильних іонів дуже мало.
Із наведених прикладів видно, що характер іонів, що утворюються при дисоціації солей, визначається природою останніх.
Константа дисоціації Кдис слабких електролітів пов’язана зі ступенем дисоціації та концентрацією слабких електролітів законом розведення Освальда:
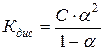 , якщо α<<1, то
, якщо α<<1, то

– Конец работы –
Эта тема принадлежит разделу:
Розчини електролітів
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... КАФЕДРА ХІМІЇ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Загальна характеристика розчинів електролітів
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов